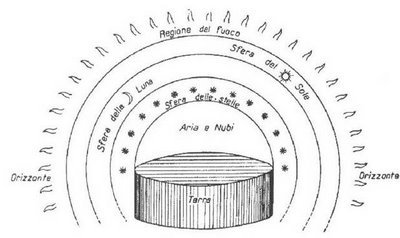
En el marc de l’esforç sistematitzador d’Aristòtil, Empèdocles d’Akragas (490-430 a.e.c.) és vist com un trencament en la línia de la filosofia presocràtica. La cosmologia empedocliana combina els quatre elements materials o “arrels” amb dos principis motors oposats: l’atracció (φιλότης) i la repulsió (νείκος). Es tracta, doncs, d’una cosmologia pluralista, en contrast amb el monisme propi dels primers filòsofs grecs. És discutible que Empèdocles consideri que les quatre arrels són quatre “arcans” irreductibles. L’arcà (ἀρχή) juga un paper central en l’escola milèsia, concebut com a “principi material”, “substància fonamental” o “element originari”. Tales de Milet (624-546 a.e.c.) considera que l’arcà és l’aigua. Els seus successors comparteixen la idea d’un únic arcà, d’un principi còsmic comú, però fan atribucions diferents. Anaximandre (610-546 a.e.c.) s’estima més identificar l’arcà amb una substància indefinida (ἄπειρον) que, en definir-se, dóna lloc a tots els altres materials. Anaxímenes (585-528 a.e.c.) identificà l’arcà amb l’aire. Forçant l’analogia, podríem dir que Heràclit d’Èfes (535-475 a.e.c.) considera que l’arcà és el foc, mentre que l’escola eleàtica identifica arcà i univers i en proclama la unitat i permanència. Similarment, per a Pitàgores, l’arcà és el nombre. La tensió entre monisme i pluralisme, entre la possibilitat o no de reduir, unificar, tot allò que existeix en un únic principi senzill, ha estat un tema recurrent en la filosofia. Els pluralistes sostenen que si l’arcà fos únic, els principis d’atracció i repulsió no haurien pogut actuar-hi, i l’univers no hauria passat mai enllà de l’estadi de massa informe. La pluralitat d’elements químics sembla donar-los la raó. Ara bé, el caràcter periòdic dels elements químics i la natura atòmica dels materials, redueix aquesta complexitat. Els àtoms són formats per tres tipus de partícules subatòmiques: protons, neutrons i electrons. El model estàndard contempla un total de 61 partícules elementals. No han mancat els intents de reduir aquesta “pluralitat” bé en forma d’un nombre més limitat de preons puntuals o d’un únic tipus de cordes. Així arribem al número 1. I si l’element 0 era identificable amb el neutró, l’element 1 ho és amb el protó.
Esquema de la cosmologia d’Anaximandre. Malgrat la pluralitat de substàncies i de localitzacions, segons Anaximandre, tota la realitat conflueix en una única substància o origen
Henry Cavendish i la descoberta de l’aire inflamable o hidrogen

Henry Cavendish (*Niça, 10.10.1731) fou el fill primogènit del matrimoni contret, el 9 de gener del 1727, entre Lord Charles Cavendish i Lady Ann Grey. Lord Charles Cavendish (*17.3.1704) era el fill petit del segon duc de Devonshire (mort el 1729) i de Rachel Russell. Lady Ann Grey era la filla d’Henry Grey, que havia esdevingut primer duc de Kent en el 1710, en renunciar a la posició de Lord Chamberlain. Ann Grey encara seria mare d’un segon fill, Frederick, nascut el 24 de juny del 1733, abans de morir-se ella mateixa el 20 de setembre del mateix any. Els dos germans foren pujats a Londres.
Des del 1725, el seu pare era membre de la Cambra dels Comuns del parlament britànic, adherits als rengles del partit whig, d’acord amb la tradició familiar. En el 1741, Charles Cavendish cedí el testimoni de la representació familiar en la Cambra al seu nebot, el marquès de Hartington. En el 1742, Henry Cavendish ingressà en la Hackney Academy, tria habitual per a les famílies de conviccions whig. Entre el 24 de novembre del 1748 i el 23 de febrer del 1753, estudià al St Peter’s College, de la Universitat de Cambridge. De retorn a Londres, pare i fill compartien una dedicació creixent a les qüestions científiques. Henry hi establí el seu laboratori.
Charles Cavendish esdevingué vicepresident de la “Royal Society of London”, societat científica dedicada a “la millora del coneixement natural” fundada en el 1660. En el 1757, Charles fou guardonat amb la medalla Copley pels seus treballs en la confecció de termòmetres per registrar les temperatures màxima i mínima de cada dia. A partir del 1758, Henry, de la mà del seu pare, començà a assistir a les reunions de la Royal Society i als sopars del Royal Society Club. En el 1760 ja era reconegut com a “Fellow of the Royal Society” i en el 1765 fou elegit membre del Consell de la Societat.
La natura de les reaccions de combustió era un dels temes als quals es dedicava Henry Cavendish. Ja en el 1667, Johann Joachim Becher havia intentat conciliar la idea tradicional alquímica dels quatre elements amb les observacions experimentals de combustió. En l’esquema de Becher els quatre elements eren l’aigua, la terra lapidea, la terra fluida i la terra pinguis. La terra pinguis seria l’element vinculat a les propietats olioses, sulfuroses i combustibles de la matèria. Segons aquesta visió, la combustió consistiria en l’alliberament, per part de la substància combustible, d’aquesta terra pinguis. En el 1703, Georg Ernst Stahl oferia una explicació similar, si bé allò que Becher anomenava “terra pinguis”, Stahl ho denominava amb un neologisme de formació grega: flogist (φλογιστόν, derivat de φλόξ, flama). La combustió, doncs, consistiria en la pèrdua del flogist d’un material combustible. La majoria de combustions, en efecte, deixen un residu de massa inferior al material combustible inicial. La majoria, però no totes. Robert Boyle (1627-1691) ja havia mostrat com l’oxidació del magnesi no resultava en una pèrdua de massa sinó de guany. En canvi, en el 1671, el mateix Robert Boyle havia descrit el despreniment de gas (reinterpretable com a flogist) quan s’aboca àcid diluït damunt de llimadures de ferro.
Henry Cavendish estudià la mateixa reacció d’atac àcid a un metall, construint un reactor que li permetés capturar l’aire sintetitzat (“factitious airs”). En el 1766 aparegué publicat el seu primer estudi, titulat “On Factitious Airs”. Cavendish es referia al caràcter inflamable d’aquest aire (“flammable air”) i suggeria la possibilitat que es tractés del “flogist”. Al capdavall, aquest “aire inflamable” era força més lleuger (menys dens) que l’aire atmosfèric, tal com suposaven els propugnadors de la teoria del flogist. Fos com fos, aquesta recerca li valgué l’obtenció d’una medalla Copley per part dels seus col•legues de la Royal Society.
En aquests anys, Cavendish combina la recerca química pneumàtica (o química de gasos), amb la participació activa en la Royal Society. Persona introvertida, sovint a l’ombra del pare, sotmetia a comunicació a col•legues o a publicació tan sols una part petita de les seves recerques sobre mecànica, òptica o magnetisme.

Dispositiu de Cavendish per a l’estudi dels “aires” (=gasos) resultants de reaccions químiques. Mentre la reacció dels àcids forts amb metalls provoca la formació d’un “aire inflamable” (el gas hidrogen, H2), la reacció dels àcids amb àlcalis provoca la formació d’un “aire fixat” (CO2). En conduir l’aire generat a una ampolla invertida plena d’aigua o de mercuri és possible confinar-lo per a estudiar-ne la solubilitat en aquests líquids, el seu pes específic i la combustibilitat.
Per tal de desencadenar reaccions de combustió dels seus “aires facticis”, Cavendish emprava habitualment les descàrregues elèctriques. En el 1771, publicava, en aquest sentit, una teoria elèctrica basada en un concepte de fluid elèctric expansiu, que exerceix una pressió.
Vers el 1781, Cavendish comença a estudiar la relació entre l’aire atmosfèric i aquests aires “facticis”. La combustió de “l’aire inflamable” conduïa a la formació d’aigua. Cavendish comunicà aquest i altres resultats a Joseph Priestley, que els entenia com a confirmadors i refinadors de la teoria del flogist.
Paral•lelament, Antoine Lavoisier (*París, 26.8.1743) oferia una teoria de la combustió (“Réflexions sur le phlogistique”, 1783) que superava la noció de flogist. Si Cavendish havia suggerit el caràcter elemental de “l’aire inflamable”, Lavoisier el definia més clarament. Per denominar aquesta substància, Lavoisier emprava el neologisme de formació grega hidrogen (de ὕδρω, aigua + γενῆς, creador). En el 1789, reconeix l’hidrogen com una de les “substàncies simples que pertanyen als tres regnes, i que hom pot considerar com els elements dels cossos”, acceptant com a “noms antics corresponents” el de “gas inflamable” i el de “base del gas inflamable”.
Lord Charles Cavendish es moria als 79 anys, el 28 d’abril del 1783. Henry Cavendish passava de llarg la cinquantena, però la seva dedicació a qüestions científiques es fa encara més sistemàtica. En el 1785, els seus estudis sobre l’aire el menen a concloure que “l’aire comú consisteix en una part d’aire deflogisticat mesclada amb quatre part d’aire flogisticat”. En termes moderns, això és dir que l’aire atmosfèric és format per un 20% d’oxigen i un 78% de nitrogen. La precisió de les balances emprades per Cavendish tenien poc a envejar amb les de Lavoisier, però la partida terminològica i conceptual la guanyava el segon. En canvi, mentre Lavoisier mantenia el 1789 la teoria material de la calor, Cavendish sostenia una teoria general de la calor alternativa.
Després de la mort del pare, Henry Cavendish adquirí una nova casa a la ciutat, a la qual traslladà la biblioteca familiar. Fora ciutat, al sud, a Clapham Common, adquirí una altra casa, on instal•là els seus laboratoris. Fou allà, entre el 1797 i el 1798, que Cavendish, mitjançant una balança de torsió estimà la força gravitatòria de la Terra i, a partir d’aquesta dades, la densitat mitjana del nostre planeta. El valor estimat per Cavendish, de 5,48 vegades la densitat de l’aigua, permet alhora una estimació de la massa de la Terra i, fins i tot, de la constant de gravitació universal (6,754•10-11 m3kg-1s-2).
Henry Cavendish es va morir el 24 de febrer del 1810. L’honor de descobridor de l’hidrogen li és disputat principalment per Antoine de Lavoisier, qui fou qui el designà amb aquest nom (1783). A més, abans que Cavendish, Paracels (1493-1541) i Robert Boyle (en el 1671) havien descrit la producció d’un gas o d’un aire a partir de l’atac àcid sobre el ferro i altres metalls. El mateix Joseph Priestley havia descobert, de manera independent a Cavendish, el mateix fenomen. Però Cavendish i Lavoisier sí havien suggerit el caràcter elemental d’aquest gas. Que l’hidrogen i l’oxigen fossin elements o substàncies simples, desproveïa l’aigua de la llista d’elements i poc després hom va determinar la famosa fórmula elemental de l’aigua com a H2O.
James Dewar (1842-1923) aconseguí la liqüefacció del gas hidrogen en el 1898, emprant el flasc de buit, a través d’un procés de refredament regeneratiu. En el 1899, Dewar aconseguí la solidificació del gas hidrogen.
Habitualment, les taules periòdiques dels elements comencen pel nombre atòmic 1, que és el que correspon a l’hidrogen (H). La natura física del nombre atòmic fou discutida. En el 1911, el model atòmic d’Ernest Rutherford distingeix entre un nucli i una escorça. Antonius van den Broek proposava una equivalència entre el nombre atòmic d’un element i la càrrega nuclar d’aquest element, idea que Henry Moseley substancià experimentals a través de l’estudi d’espectres de raigs X (1913).
El bombardeig amb radiació alfa de gas hidrogen permeté Rutherford de produir nuclis d’hidrogen. El fet que el bombardeig amb radiació alfa sobre el gas nitrogen produís senyals equivalents als nuclis d’hidrogen, dugué a Rutherford a postular que el nucli d’hidrogen és component d’altres nuclis atòmics. Per evitar, una confusió terminològica, en el 1920, Rutherford avançà el nom “protó” per designar el “nucli d’hidrogen”.
La identificació “nucli d’hidrogen” = “protó”, però, no és exacta. A final del 1931, Harold Urey detectà espectroscòpicament en hidrogen líquid la presència de diferències isotòpiques. Aquestes diferències eren presents també en l’hidrogen de l’aigua (H2O). En el 1934, Urey parlava de tres isòtops de l’hidrogen, el proti (el més lleuger i abundant), el deuteri (amb una massa atòmica equivalent a 2 protis) i el triti (amb una massa atòmica equivalent a 3 protis i, a diferència dels altres dos, inestable o radiactiu).
L’hidrogen: isòtops i abundància
El llistat d’isòtops coneguts de l’hidrogen és el següent:
– hidrogen-1 (proti, 1H), de massa atòmica 1,00782504 uma). El seu nucli consisteix en un únic protó. Més del 99,98% dels àtoms d’hidrogen són àtoms de proti. És un isòtop estable. No obstant, si és cert que la semivida del protó no és infinita, sinó d’un valor finit (com ara 1043 segons), no hi hauria lloc a parlar d’estabilitat. Empíricament, s’ha trobat una estimació mínima de semivida del proti de 2,1•1041 segons. Com que l’edat de l’univers es computa en 4•1017 tampoc no és que sigui gaire rellevant per al moment present.
– hidrogen-2 (deuteri, 2H, encara que té també com a símbol propi la lletra D). El seu nucli consisteix en un protó i un neutró. Com que la massa atòmica duplica la del proti (2,01410178 uma) és fàcil que es produeixin fraccionaments en el seu abundor. Hom calcula que la concentració relativa de deuteri en l’univers primitiu era de l’ordre de 27 ppm respecte l’hidrogen total. La xifra tendeix a disminuir en les regions galàctiques més velles (població estel•lar II, on ronda els 23 ppm). En el Sistema Solar exterior, la xifra és similar a la de l’univers primitiu, però hi ha una tendència a l’acumulació en els planetes. Per exemple, a la Terra la concentració relativa va de 26 ppm (atmosfera) a 184 ppm (oceans).
– hidrogen 3 (triti, 3H, amb símbol propi com a T). Consisteix en un protó i dos neutrons (massa de 3,0160492 uma). És un isòtop inestable, amb una semivida de 3,888•108 s, que decau per donar lloc a heli-3 (3He, nucli format per dos protons i un neutró). La principal font natural a la Terra de triti és la interacció dels raigs còsmics amb els gasos de les capes altes de l’atmosfera. Se l’obté de manera artificial a través del bombardeig amb neutrons del liti-6 (6Li) .
– hidrogen-4 (4H, nucli format per 1 protó i 3 neutrons; massa de 4,02781 uma). De vegades denominat quadi. Hom l’ha sintetitzat en el laboratori a través del bombardeig amb deuteri de triti. Té una semivida molt breu (1,39•10-22 s), abans de perdre un dels neutrons.
– hidrogen-5 (5H, nucli format per 1 protó i 4 neutrons; 5,03531 uma). Se l’ha sintetitzat en el laboratori pel bombardeig de triti amb triti. Té una semivida molt breu (9,1•10-22 s).
– hidrogen-6 (6H, nucli format per 1 protó i 5 neutrons; 6,04494 uma). La semivida és de 2,90•10-22.
– hidrogen-7 (7H, nucli format per 1 protó i 6 neutrons; 7,05275 uma). Korsheninnikov et al. (2003) aconseguiren la síntesi d’aquest isòtop d’hidrogen, el més pesant dels qui es té notícia, a través del bombardeig d’hidrogen amb àtoms d’heli-8 (8He). La semivida és de 2,3•10-23 s.
L’àtom neutre d’hidrogen conté un únic electró (configuració 1s1). La massa atòmica estàndard de l’hidrogen és de 1,008 (resultant de la mitjana ponderada del proti i del deuteri).
L’hidrogen és l’element més abundant de l’univers. Més del 90% dels àtoms de l’univers són àtoms d’hidrogen, la qual cosa suposa que un 75% de la matèria bariònica consisteix elementalment en hidrogen. En el medi interestel•lar, l’hidrogen es troba habitualment bé en forma atòmica (H) i, menys abundantment en plasma (H+; protons). També se’l pot trobar en núvols de H2 (associats sovint a zones de formació de nous estels) i com a element de la majoria de compostos químics (aigua, amoni, compostos orgànics). La ionització de l’hidrogen molecular condueix a la formació de H3+.
En la superfície terrestre, l’hidrogen és el tercer element més abundant, bàsicament en forma de compostos químics (aigua, matèria orgànica). El gas hidrogen (H2) és molt poc abundant en l’atmosfera terrestre (1 ppm).
L’economia d’hidrogen
Ja en el 1783, Jacques Charles emprava “l’hidrogen” o “gas inflamable” per fer volar un globus. Els primers dirigibles d’hidrogen daten del 1852 (Henri Giffard), si bé els més coneguts són els construïts pel comte Ferdinand von Zeppelin, que començaren a volar en el 1900. L’accident del Hindenburg, el 6 de maig del 1937, va perjudicar molt la reputació del gas hidrogen i, en tot cas, les millores en els avions ja havien començat a desplaçar els dirigibles.

L’incendi del Hindenburg, amb 36 víctimes mortals, ha quedat en l’imaginari com el cant del cigne dels dirigibles com a transport transoceànic de passatgers
Però quan parlem d’economia d’hidrogen ens referim a uns altres usos del gas hidrogen, concretament com a forma d’emmagatzemar energia. En el 1923, JBS Haldane afirmava el següent:
Personalment crec que en quatre-cents anys la qüestió energètica a Anglaterra es podria resoldre una mica així: el país seria cobert de rengles de molins de vent metàl•lics que fessen anar motors elèctrics que alhora subministrassen corrent a un voltatge molt alt a grans vies elèctriques. A una distància adient hi hauria gran estacions energètiques on durant l’època de vents l’energia excedentària seria emprada per a la descomposició electrolítica de l’aigua en oxigen i hidrogen. Aquests gasos serien liquats i guardats al buit en enormes reservoris estancs, probablement soterrats. Si aquests reservoris són prou grans la pèrdua de líquid degut a entrades de calor no seria gran; així la proporció que s’evaporaria diàriament d’un reservori de 100 iardes quadrades i de 60 peus de profunditat no seria ni una mil•lèssima de la pèrdua d’un tanc que mesuràs dos peus per banda. En temps de calma, els gasos es recombinarien en motors d’explosió que fessen anar dinamos que produissin energia elèctrica una vegada més, o més probablement en cèl•lules d’oxidació. L’hidrogen líquid és pes per pes el mètode més eficient conegut d’emmagatzemar energia, ja que dóna per lliura unes tres vegades més calor que el petroli. D’altra banda és molt lleuger, i volum per volum té tan sols una tercera part de l’eficiència del petroli. Això, però, no n’impediria l’ús en avions, on el pes és més important que el volum. Aquests enormes reservoris de gasos liquats permetrien l’emmagatzematge de l’energia eòlica, de forma que es pugués esmerçar en la indústria, el transport, la calefacció i l’enllumenat, a voluntat. Els costos inicial seran ben considerables, però les despeses de manteniment serien inferiors a les del nostre sistema actual. Entre els seus avantatges més obvis hi ha el fet que l’energia serà tan barata en una part del país com en l’altra, de forma que la indústria es descentralitzaria enormement; i no es produirien ni fum ni cendres.
Haldane recollia en aquest passatge diverses idees que remuntaven a les darreres dècades del segle XIX. En el 1970, John Bockris emprava el terme “economia d’hidrogen” (hidrogen economy) en una conferència pronunciada en el General Motors Technical Center. El gas hidrogen no és pensat pas com una “font d’energia”, sinó com una forma d’emmagatzematge d’energia i, a més, aplicable a l’ús com a combustible en l’automoció.
A mitjan de la dècada passada, la producció mundial de gas hidrogen era de 57 milions de tones mètriques (amb una equivalència energètica a la de 170 milions de tones de petroli) i creixia a un ritme anual del 10%. La major part de la producció d’hidrogen s’obté de combustibles fòssils: gas natural (48%), petroli (30%) i carbó (18%).
Gairebé la meitat de l’hidrogen produït es destina a la producció d’amoni (NH3) mitjançant el procés d’Haber (N2 + 3 H2 → 2 NH3), com a pas primer en la síntesi de fertilitzants. Una bona part de la producció restant es destina a l’hidrocracking, la conversió de fonts pesants d’hidrocarburs en hidrocarburs més lleugers.
La transició a una economia d’hidrogen (que Haldane, com hem vist, desplaçava prudentment al segle XXIV) requeriria que la major part de la producció de gas hidrogen es fes a través de l’electròlisi d’aigua. Actualment, tan sols un 4% del gas hidrogen produït s’obté per aquest procés. Alhora, l’energia elèctrica necessària per a l’electròlisi s’obté bàsicament de les centrals tèrmiques que cremen combustibles fòssils. La idea, doncs, és acoblar els excedents periòdics de les fonts energètiques alternatives, a la producció de gas hidrogen. Com a reservori d’energia, aquest gas hidrogen es destinaria preferentment a la locomoció.
Són molts els aspectes que requereixen encara un fort impuls: mètodes de producció d’hidrogen, mètodes d’emmagatzematge eficient, desenvolupament de cèl•lules de combustió d’hidrogen efectives per a la locomoció, etc.

TMB ha lloat el “bus d’hidrogen” pel fet que emet vapor d’aigua com a producte de la combustió (2H2 + O2 → 2H2O). No obstant, si comptem les emissions de gasos d’efecte hivernacle que ha comportat la combustió de gas natural i d’altres combustibles fòssils per a la síntesi del gas hidrogen, la “petja de carboni” no és tan lleugera
Algunes limitacions tecnològiques, han fet que hom postuli escenaris alternatius i combinats. El temps dirà si el panorama dibuixat per Haldane en el 1923 es correspon a la realitat energètica de la segona meitat del segle XXI.
Molt bona la reflexió sobre “la petjada de carboni” de la síntesi del gas. Aquest és un aspecte sempre deixat de banda per part dels ecologistes.
[…] nom homenatjava alhora la família en general com particularment a Henry Cavendish (1731-1810), de qui vam parlar en el seu moment. La càtedra havia estat ocupada per James Clerk Maxwell, mundialment famós per “A Treatise on […]