El grup d’epigenòmica biomèdica de José Ignacio Martín-Subero (IDIBAPS) i el de genòmica i dinàmica evolutiva del professor Trevor Graham (ICR) han desenvolupat la metodologia EVOFLUx per seguir la fluctuació de la metilació d’ADN de llinatges cel·lulars. La metilació de l’ADN és una modificació epigenètica, però és que les fluctuacions epigenètiques (epimutacions) també fan part del procés evolutiu que hi ha al darrera del desenvolupament del càncer i de la resposta del càncer als tractaments antitumorals. EVOFLUx infereix quantitativament la dinàmica evolutiva a partir d’un perfil de metilació del tumor. El biòleg matemàtic Calum Gabbutt és el primer autor d’un article publicat ahir a la revista Nature on s’aplica EVOFLUx a 1976 mostres ben caracteritzades de càncer limfoide. En els diferents tipus de càncer limfoide hi ha una gran variabilitat quant a la taxa inicial de creixement tumoral, la malignització o la taxa d’epimutació. Els subtipus més agressius solen presentar un creixement tumoral inicial més ràpid. EVOFLUx té una aplicació potencial en el pronòstic de la leucèmia limfocítica crònica. Alhora, mostra que en leucèmies limfocítiques cròniques agressives amb transformació de Richter la llavor del clon transformat remuntava a dècades abans del diagnòstic.
La fluctuació en la metilació de seqüències CpG de l’ADN permet la reconstrucció filogenètica de mostres de càncer limfoide
L’accés a la dinàmica evolutiva del càncer
Gabbutt et al. parteixen de la comprensió del desenvolupament del càncer com un procés evolutiu. Així doncs, conèixer la història evolutiva d’un cas de càncer pot ajudar fer pronòstic clínic del pacient. En la pràctica semblaria que això passa per disposar de mostres recollides longitudinalment al llarg del temps. Ara bé, malgrat que hom disposi d’una única mostra, és possible emmarcar les mutacions i epimutacions presents en ella en un context evolutiu.
En els càncers del sistema hematològic pot resultar més senzill disposar de mostres. Alhora, les tècniques de seqüenciació ja es poden aplicar a cèl·lules individuals o a colònies derivades d’una sola cèl·lula. Tot i amb tot, la despesa és encara massa elevada com perquè tingui una traducció clínica rellevant.
Per resseguir un llinatge cel·lular les mutacions en la seqüència nucleotídica poden ésser massa rares. En canvi, la metilació d’ADN pot ésser un marcador de llinatge més eficient, aplicable a la reconstrucció de l’arquitectura clonal d’una població cel·lular. De particular interès són els llocs CpG del genoma que són objecte d’una metilació que fluctua estocàsticament al llarg dels anys. Aquests llocs, fCpGs, constitueixen una mena de ‘codi de barres’ de metilació.
EVOFLUx es fonamenta en aquests fCpG. Funciona atenent l’heterogeneïtat dels valors de metilació en fCpG dins d’una mateixa mostra. Per a cada locus diploide, cada fCpG pot trobar-se en un d’aquests tres estats: 1) 0% de metilació; 2) 50% de metilació; i 3) 100% de metilació. Cada fCpG fluctua de forma independent, de manera que si hom empra n fCpGs, n’obté 3n patrons possibles. Dues cèl·lules somàtiques amb un ancestre recent compatiran en gran mesura aquest patró de metilació fCpG: com més distancia filogenètica hi hagi menor serà la similitud. En una població, el patró fCpG dominant serà representatiu de l’estat fCpG de la cèl·lula fundadora.
Les neoplàsies limfoides es poden entendre com una població cel·lular. N’hi ha de tota mena: des d’altament proliferatives i agudes, fins a leucèmies cròniques indolents. Algunes apareixen en infants, i d’altres en gent gran. D’un mateix pacient es poden prendre mostres en diferents períodes de la malaltia. Mostres de càncer limfoide han estat intensament estudiades pel que fa al perfil de metilació d’ADN. En aquest estudi, Gabbutt et al. apliquen EVOFLUx a 1976 tumors limfoides malignes ben caracteritzats, dels quals hom disposa informació clínica exhaustiva.
Els fCpGs de càncers limfoides
Gabbutt et al. han aplegat dades de metilació en plataforma de seqüenciació Illumina de 2430 mostres de cèl·lules limfoides, algunes de normals i d’altres neoplàsiques. Després d’un filtratge de control de qualitat, conservaren 2204 mostres, corresponents a 2054 pacients. En aquestes 2204 mostres hi ha dades corresponents a 389.180 CpGs.
Per identificar-hi els fCpGs, Gabbutt et al. utilitzaren 1471 mostres de tumors limfoides. Així identificaren 978 fCpGs pan-limfoides.
En cada mostra individual de càncer els fCpGs permeten destriar el patró corresponent a la cèl·lula fundadora. En contrast, les subpoblacions sanes de limfòcits B tenen distribucions unimodals de fCpGs, que reflectirien el seu origen policlonal.
Entre els 978 fCpGs, hi ha correlacions en 74, que s’expliquen pel fet trobar-se a menys de 1 kb de distància cromosòmica. Les dades de seqüenciació genòmica amb bisulfit (WGBS) de poblacions de limfòcits són intermèdies, indicatiu del seu origen policlonal, però també ací trobem que CpGs veïns tenen un nivell de metilació correlacionat.
Però fins a quin punt els fCpGs són codis de barra evolutius? Gabbutt et al. han comprovat que l’heterogeneïtat de fCpGs entre pacients no és causada per polimorfismes nucleotídics habituals. La seqüenciació de 6 limfòcits B normals i de 6 mostres aparellades de leucèmia limfocítica crònica els permet detectar simultàniament mutacions d’ADN i els fCpGs: entre els dos fenòmens no hi ha una correlació. Sí hi ha concordança entre els nivells de metilació de fCpG i les dades de WGBS. En les mostres de leucèmia limfocítica crònica hi ha menys heterogeneïtat intra-haplotip en comparació amb els limfòcits B normals: això s’explica per l’origen de la leucèmia en una expansió clonal que contrasta amb la policlonalitat del teixit normal.
Gabbutt et al. utilitzen 492 mostres de leucèmia limfocítica crònica (CLL) i 85 de limfoma de cèl·lula del mantell (MCL) per estudiar la relació entre alteracions de nombre de còpia i els valors de fCpGs. La relació és independent per a cada al·lel.
L’anàlisi de mostres de sang normal indica que la metilació mitjana de fCpG no es correlaciona amb l’edat. Les fluctuacions de metilació, doncs, continuarien al llarg de la vida, i per això mateix la variança d’aquesta variable augmenta amb l’edat. La variança també és superior en mostres que han experimentat una expansió clonal recent. Això vol dir que EVOFLUx podria ésser útil en la detecció d’expansions clonals del sistema hematopoiètic associades a l’edat.
Els fCpGs són més habituals en les vores de les anomenades illes CpG. En canvi, són menys freqüents en regions associades a gens. Els fCpGs es diferencien dels CpGs utilitzats en els rellotges epigenètics clàssics. En mostres de CLL, els gens associats amb fCpGs tendeixen a ésser de baixa expressió, però no es detecta una associació entre l’estatus de metilació fCpG i l’expressió del gen associat. Tampoc no hi ha correlació entre la metilació fCpG i l’expressió de gens modificadors de la metilació d’ADN. Els gens associats a fCpG tendeixen a participar en vies de desenvolupament. Tot plegat ens fa veure els fCpGs com un marcadors de llinatge neutrals, localitzats preferentment en regions silents del genoma que no participen en la regulació de la transcripció.
Una mesura de l’evolució clonal
EVOFLUx simula com l’evolució clonal determina quantitativament els valors de metilació fCpG. En un llinatge cel·lular hi ha una fluctuació (guany o pèrdua) de metilació en fCpGs. Aquesta fluctuació arrenca des del naixement del pacient fins a l’inici de l’expansió clonal associada al càncer, i continua després fins el moment que es pren la mostra de càncer. Els paràmetres més rellevants de la modelització són la taxa de creixement del càncer, l’edat del pacient en l’inici del creixement tumoral, les taxes de canvi en l’estat de metilació de cada fCpG. Això permet calcular el nombre de llinatges de llarga vida del càncer. També permet detectar expansions subclonals en el tumor.
L’evolució de tumors limfoides malignes
Gabbutt et al. apliquen EVOFLUx a 1976 mostres de càncer limfoide, incloent-hi T-ALL, B-ALL, CLL, MCL, DLCBCL (limfoma difús de gran cèl·lula B) i mieloma múltiple, així com de tumors pre-malignes com el MBL (limfocitosi monoclonal de cèl·lula B) o la gammopatia monoclonal. De cada mostra hi ha informació sobre l’edat del pacient i la puresa cel·lular.
EVOFLUx infereix la taxa de creixement de cada càncer, el temps de divergència des de l’ancestre comú més recent i les taxes de canvi epigenètic.
Les històries evolutives són molt diverses. Les neoplàsies ALL tenen una alta taxa de creixement, una mida de població efectiva més petita i un origen més recent. Les neoplàsies T-ALL creixen més ràpidament que les B-ALL. En l’altre extrem tenim l’evolució lenta i perllongada de MBL. En DLBCL trobem el nombre de població efectiva més elevat.
Els tumors pediàtrics tenen una major fluctuació de metilació de fCpGs que els adults.
Una evolució variable segons el tipus tumoral
Hi ha una relació entre el comportament clínic del tipus tumoral i l’evolució del tumor. Els tumors més indolents tenen una taxa de creixement inferior.
Entre els CLL, el subtipus U-CLL és més agressiu, i té també una taxa de creixement superior als M-CLL. En U-CLL la mida efectiva de població també és superior a M-CLL.
Mutacions en el gen TP53 són marcadors de pitjor pronòstic. EVOFLUx troba en els tumors CLL portadors d’aquesta i altres mutacions clau una major taxa de creixement i una major població efectiva. La trisomia 12 s’associa amb una mida de població efectiva més elevada, però no amb una major taxa de creixement.
L’arquitectura subclonal
Teòricament en l’evolució d’un tumor, els subclons que tinguin un avantatge seran seleccionats positivament. En uns pocs casos de CLL hi ha dos o més clons amb orígens independents. Les dades de fCpG permeten descriure l’arquitectura clonal a través de pics intermedis en la distribució de la metilació. Les simulacions indiquen que EVOFLUx tan sols pot detectar subclons amb una forta selecció.
Gabbutt et al. descriuen l’evolució de tumors sense subclons detectables com una evolució efectivament neutra. De fet, dels 1976 tumors analitzats, 1610 no mostren presència de clons subclonals o independents. Ara bé, entre els CLL, més d’un 30% (232 de 718) mostren aquesta subclonalitat.
En 425 casos de CLL amb els que hi ha dades de seqüenciació d’exoma complet (WES), l’ús del programari MOBSTER evidencia subclons en 78. En 127 mostres de CLL amb dades de seqüenciació genòmica completa (WGS), hi ha una coincidència entre MOBSTER i EVOFLUx en la detecció de subclons.
En els 718 casos de CLL analitzats, n’hi ha 22 que presentarien origen clonals diferents.
La dinàmica clonal
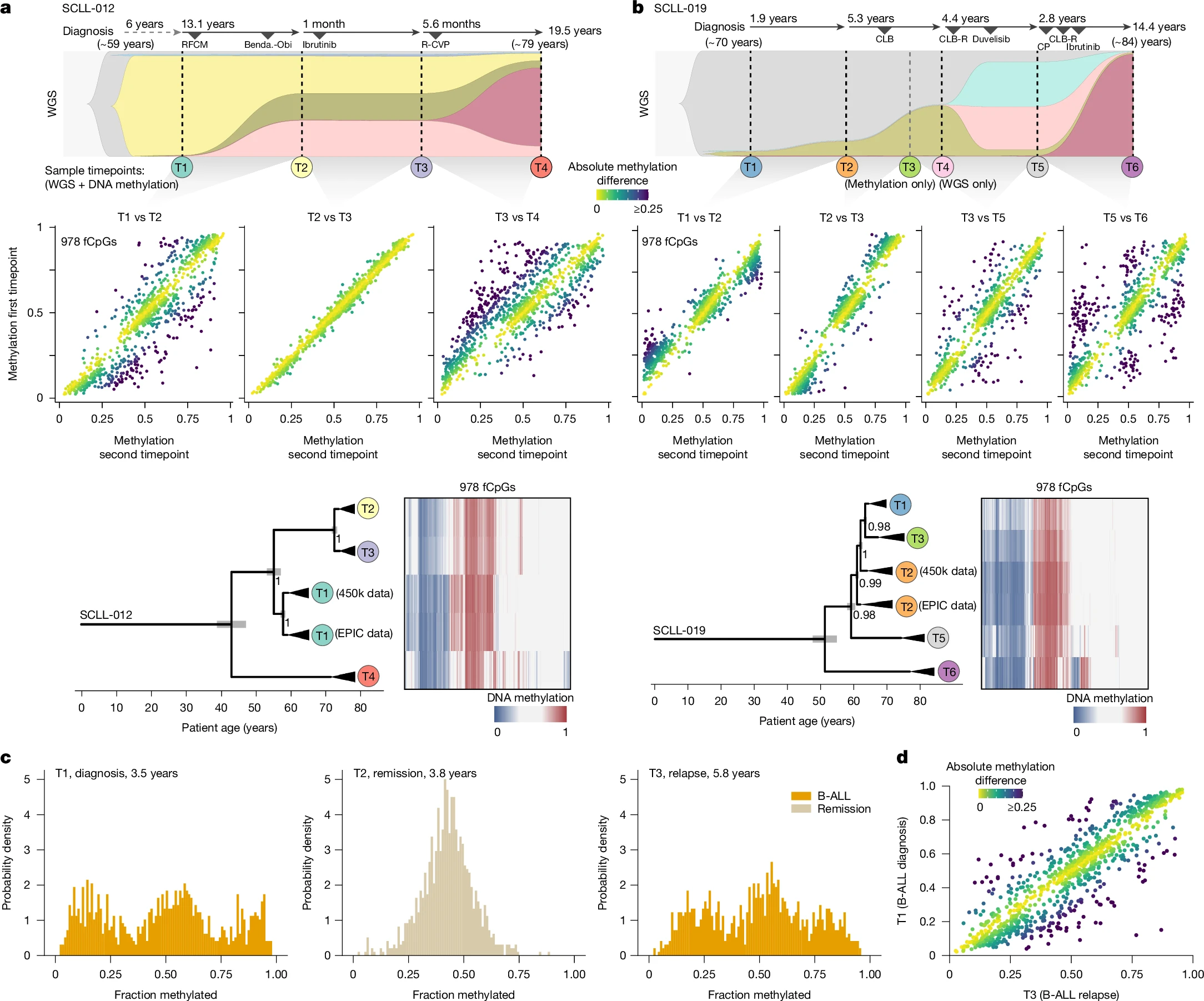
La transformació de Richter en pacients amb CLL és un marcador d’agressivitat de mal pronòstic. Gabbutt et al. segueixen de dos pacients als qui se’ls havia un fet un seguiment posterior de 19,5 i de 14,5 anys.
En el cas 12 de CLL, les dades de WGS indicaven una expansió clonal, que també és detectada en fCpGs, entre la primera mostra (T1) i la segona (T2), separades per 13,1 anys. Aquest pacient va rebre un tractament amb ibruntinib després de T2, i al cap d’un mes se’n prengué una tercera mostra (T3). Llavors el pacient va rebre una combinació de medicaments. Al cap de 5,6 mesos, es va prendre una quarta mostra (T4), quan ja hi havia una manifestació clínica de transformació de Richter.
En el cas 19 de CLL, les primeres quatre mostres (T1-T4) abastaven un període de 7,1 anys. En les mostres es podia seguir per WGS i per fCpG l’expansió gradual d’un subclon. La mostra T5 es va prendre al cap de 5,5 anys, i hi havia l’expansió d’un subclon del subclon. En la mostra T6, presa al cap de 2,8 anys, el pacient ja havia estat diagnosticat de transformació de Richter.
En aquests dos casos, les dades de fCpG feien veure que el clon que eventualment experimentà la transformació de Richter havia divergit dècades abans.
En casos de recaiguda de B-ALL, les mostres de la recaiguda formen un clade separat de la mostra del diagnòstic inicial. El tractament antitumoral hauria produït un coll d’ampolla evolutiva. Durant el període de remissió, les mostres de sang reflectien una distribució unimodal de fCpG, que es perdia en la recaiguda.
La relació entre evolució tumoral i clínica
En 478 casos de CLL es pot veure que els de creixement més ràpid també condueixen a un tractament més primerenc, però alhora a una pitjor supervivència. El nombre de població efectiva no influeix en la rapidesa del primer tractament, però sí que s’associa a una pitjor supervivència.
En una altra cohort de 209 pacients amb CLL, la taxa inicial de creixement tumoral és un predictor de l’inici del tractament.
Gabbutt et al. pensen que EVOFLUx és una eina cost-efectiva en la predicció del comportament clínic de CLL. Aquesta eina quantifica aspectes centrals de l’evolució tumoral. És un bon complement a l’estudi fenotípic de les mostres tumorals.
EVOFLUx també és aplicable a mostres de sang, oferint dades sobre la clonalitat del sistema hematopoiètic.
Lligams:
– Fluctuating DNA methylation tracks cancer evolution at clinical scale. Calum Gabbutt, Martí Duran-Ferrer, Heather E. Grant, Diego Mallo, Ferran Nadeu, Jacob Househam, Neus Villamor, Madlen Müller, Simon Heath, Emanuele Raineri, Olga Krali, Jessica Nordlund, Thorsten Zenz, Ivo G. Gut, Elias Campo, Armando Lopez-Guillermo, Jude Fitzgibbon, Chris P. Barnes, Darryl Shibata, José I. Martin-Subero & Trevor A. Graham. Nature (2025).