En parlar de Berzelius vam comentar la teoria del dualisme electroquímic, que derivava directament de l’ús de les tècniques elèctriques (galvàniques) per a la descomposició de substàncies químiques en les seves arrels o elements fonamentals. Humphry Davy, a partir del 1807, quedà consagrat com el descobridor de diversos elements químics aplicant l’electròlisi. És habitual en la literatura actual, fer servir en parlar dels estudis de Davy les paraules “ànode” o “càtode” per referir-nos als dos pols de la cèl•lula electroquímica. Aquests termes, però, no apareixen fins més tard, de la mà del deixeble més destacat de Davy, Michael Faraday. Fins llavors, Davy, Faraday i els altres investigadors, no designaven de manera especial els dos pols de la cèl•lula. Per exemple, Faraday emprava els termes est (East) – oest (West), perquè s’havia acostumat a orientar en aquesta direcció geogràfica les cèl•lules electrolítiques, amb la finalitat que el camp magnètic terrestre afectés uniformement tots els experiments. En el 1833, en un esforç per fixar la terminologia de la tècnica, Faraday consultà amb William Whewell (1794-1866), per la seva perícia en llengües clàssiques. Per designar les direccions que prenien les substàncies en la cèl•lula elèctrica, quedava clar el mot grec odos (οδος, camí). El parell eastode/westode disgustava Whewell per la combinació d’elements anglesos i grecs, i Faraday, d’altra banda, sabia que els experiments també funcionaven si hom capgirava la disposició dels components de l’aparell. El parell oriode/occiode enfosquia l’etimologia tan sols una mica i, a més, combinava arrels llatines i gregues. El parell disiode/analotode també fou considerat. Si hom emprava prefixos grecs més generals de direcció, apareixia eisode/exode (literalment, entrada i sortida). Finalment, escolliren ànode/càtode (literalment, direcció de pujada i direcció de baixada) i, arbitràriament, assignaren el primer al “East” i el segon al “West”. El gener del 1834, el recull de Faraday “Experimental Researches in Electricity” (1834) ja preferia el terme corrent elèctric a corrent galvànic. A partir del terme “electròlisi” introduïa el verb “electrolitzar” (anglès, electrolyze) i el terme “electròlit” (anglès, electrolyte, producte final de l’electròlisi). S’introduïa el terme elèctrode per designar genèricament els dos pols o direccions de l’electròlisi, cadascun dels quals rebia els noms respectius d’ànode i de càtode. L’electròlit que s’acumulava en l’ànode rebia el nom d’anió, i el que s’acumulava en el càtode rebia el nom de catió. Tots dos termes es basaven en ἰόν, participi present del verb ιεναι, que clàssicament podem traduir com “anar”, però que també significava figurativament afanyar-se, desitjar. D’anió i de catió sorgia el terme ió. Ió seria qualsevol espècie química (àtom o molècula) carregada elèctricament. La descoberta de l’electró, com a àtom de l’electricitat, ja a final del segle XIX, no va alterar la terminologia. L’electró, com a anió, va ser considerat una partícula de càrrega “negativa”, d’acord amb la convenció fixada per Faraday moltes dècades abans. Així, en un camp elèctric, els electrons migren cap al càtode, literalment “van cap avall”. Però també podria haver estat a l’inrevés, i ara diríem que els electrons tenen càrrega “positiva” i que, en el camp elèctric, migren cap a l’ànode”, és a dir que “van cap amunt”. Amb el temps on va identificar els ions amb àtoms i molècules carregades elèctricament, com a conseqüència d’un desequilibri entre el nombre de protons i el nombre d’electrons. De fet, de la matèria atòmica de l’univers, la immensa majoria (>99,9%) es troba en forma de gas ionitzat o plasma. Nosaltres, en tot cas, arribem al nombre 19 de la nostra sèrie.

Esquema d’un aparell electrolític de Hoffman. El disseny bàsic d’August Wilhelm von Hofmann (1818-1892) es basava en les cèl•lules electrolítiques desenvolupades molt a començament del segle XIX. Humphry Davy aplicà l’electròlisi en el 1807 per caracteritzar químicament la sosa, la potassa, la cal i altres substàncies. La terminologia bàsica, però, d’ànode/càtode, i d’anió/catió, no aparegué fins el 1834
Humphry Davy i la descoberta del potassi

De Humphry Davy ja vam parlar fa unes setmanes. A vint-i-set anys, i després de sis anys, a la Royal Institution, Davy aplica els seus coneixements sobre galvanisme en l’anàlisi de diversos compostos químics d’interès generals, entre ells substàncies càustiques o alcalines com la potassa.
La paraula “potassa” prové de l’alemany “pottasche”, que significa literalment cendra del caldera. El terme designa les cendres obtingudes de la combustió de material vegetal. El seu equivalent àrab, القَلْيَه , al-qalyah, fa referència també a “cendres vegetals”. Naturalment, la potassa o àlcali que resulta finalment depèn dels materials originaris. Les elevades temperatures fan desaparèixer no tan sols tota la humitat sinó també tota la matèria orgànica. La paraula “àlcali”, introduïda en les llengües europees, faria especialment referència al material càustic, tant si és d’origen mineral (sosa càustica) com d’origen vegetal (potassa càustica). Ara bé, també hi ha menes de potassa que no són càustiques. També cal dir que, des del segle XIV, hom explotava a Etiòpia potasses d’origen mineral.
El caràcter bescanviable de soses i potasses feia pensar que es tractava del mateix material, per bé que d’orígens diferents, i que allò pertinent, més que no pas si eren d’origen mineral o vegetal, era el seu grau de causticitat, d’acord amb el qual tindrien unes aplicacions o unes altres. En els països germànics, la potassa era elaborada a partir de llenya; cremada, les cendres eren deixades en aigua en pots de ferro; un cop evaporada l’aigua, se’n recollia un residu blanc. Si hom volia que aquesta potassa fos càustica, això podia aconseguir-afegint potassa a una solució concentrada de cal apagada: evaporada, en resultava potassa càustica. La potassa comuna, d’altra banda, s’emprava en el treball del vidre i en la confecció de sabons (si abans no, des del segle VI d.C.).

Georg Ernst Stahl
Georg Ernst Stahl (1659-1734) s’ocupà de la relació entre la sosa i la potassa. En el 1702, enumerava diferències entre les soses d’origen mineral i les soses d’origen vegetal (és a dir, les potasses). Encara que això no tingués una conseqüència en la majoria d’aplicacions pràctiques d’aquests materials, sí les tenia en les discussions científiques sobre la matèria viva, en les quals Stahl adoptava una posició vitalista o animista enfront dels mecanicistes.

Henri-Louis Duhamel du Monceau
Henri-Louis Duhamel du Monceau, en el decurs de les serves recerques sobre agricultura i silvicultura, s’ocupà en el 1736 de la caracterització química de la potassa, de la qual parlà en un article sobre la base de sal marina, en el qual forneix proves experimentals de la diferència química entre la potassa i la sosa.
En el 1742, Antonio Campanella aïlla la sal que és el principal component de la potassa, i mostrà que coincidia amb les sals de tàrtar (“cendres de perles”, obtingudes de la ignició dels residus del vi).
De la diferència entre la sosa i la potassa càustiques també se n’ocupa Andreas Sigmund Marggraf (1709-1782), en el capítol dedicat als àlcalis d’una obra del 1763.
En el 1790, Samuel Hopkins patentava als Estats Units un aparell i un procés per a la confecció de “Pot ash” i “Pearl ash”. Les cendres de perla oferien una potassa de major qualitat. Entre les aplicacions creixents d’aquests productes hi havia la panificació sense llevat, per a la producció dels anomenats “quick breads”.
En el 1807, Humphry Davy realitza l’electròlisi de potassa càustica amb una pila voltaica, i n’obté una substància metàl•lica. Més tard repeteix l’experiment amb sosa càustica, i n’obté una altra substància metàl•lica. Davy interpretà els resultats com la descoberta de dos elements químics diferents, i així ho comunicà en una conferència del 19 de novembre del 1807. La base metàl•lica de la potassa va rebre el nom de potassi (potassium) i la de la sosa el de sodi (sodium). Com a nom genèric de tots dos metalls, quedava el terme de “metall alcalí”. El potassi era un metall molt inestable, fàcilment oxidable i que, per acció de la humitat, tornava a la forma composta de la potassa càustica.
John Dalton, a “New System of Chemical Philosophy” (1808) exposa una teoria atòmica. Parla de la potassa com un element simple, com també de la sosa. Si la sosa és representada en un cercle amb dues ratlles verticals, la potassa ho és amb tres ratlles. En edicions posteriors, Dalton ja adopta la terminologia proposada per Davy, i esmenta el potassi i el sodi com a elements simples, mentre la potassa i sosa es correspondrien a diferents elements compostos.
D’acord amb aquest esquema, la potassa càustica és un compost format per potassi, oxigen i hidrogen. L’òxid de potassi, per potassi i oxigen. La potassa comuna (no-càustica) es correspon a una sal de potassi, carbonat, clorur, nitrat, sulfat o d’un altre tipus.
Encara que per a la majoria d’aplicacions (vidre, neteja, fabricació d’explosius), les sals de sodi i de potassi eren bescanviables, hi havia casos en els quals hom preferia les de potassi. Els sabons de potassi, obtinguts a partir de potassa càustica i d’olis o greixos vegetals o animals, eren denominats “sabons tous” (“soft soaps”), per la seva textura més suau, i per ser més solubles e aigua, que no pas els sabons de sodi (altrament, d’ús majoritari i més assequible econòmicament). Els sabons tous eren preferits en la preparació de llana per fer-ne fil, i això estimulà la importació de potassa del Canadà (que ja havia començat a mitjan del segle XVIII).
Quan, en el 1813, Jöns Jacob Berzelius introdueix un sistema de símbols químics basats en les inicials dels elements, el potassi és representat com a “Po”, de la mateixa manera que el sodi ho és per “So”. Ara bé, el mot “potassi”, com hem vist, prové de la llengua germànica, mentre que el mot “sodi” ho fa de l’àrab. El mot corresponent al “sodium” en la literatura llatina clàssica és “natrium”, i això farà que el símbol químic “So” sigui substituït per “Na”. En el cas del “potassi” no hi ha un equivalent clàssic, però hom tria “kalium”, mot neollatí construït a partir d’àlcali (terme, com hem vist, d’origen àrab). Així, el símbol químic del potassi deixà de ser “Po” per ser “K”. Paradoxalment, en àrab modern, hom empra el terme بوتاسيوم (butasyum), mentre les llengües germàniques han optat per “kalium”, en una curiosa inversió terminològica, explicable pel fet que en àrab hom ha retingut l’arrel “al-qalyah” per referir-se genèricament als metalls i als compostos alcalins. En anglès i en les llengües romàniques ha prevalgut potassi, mentre les llengües eslaves s’han estimat més kali. Les altres llengües s’han repartit entre una opció i l’altra, i algunes poques han optat per termes equivalents a la idea de “cendra vegetal”.
En el 1840, Justus Liebig, constatava a “Die organische Chemie” la rellevància del potassi en l’agricultura. Com indicava la seva mateixa etimologia, el potassi és un element necessari per a les plantes, i en molts tipus de sòl apareix com el nutrient limitant. Després del nitrogen i del fòsfor, el potassi era doncs l’element químic més rellevant.
En el 1817, quan es va descobrir un nou metall alcalí, Berzelius suggerí el nom del liti per al nou element, que havia estat descobert en un mineral (la petalitat). Berzelius remarcava que mentre el liti havia estat descobert en un mineral i el potassi en material vegetal, el sodi era especialment abundant en els fluids corporals dels animals. En el 1817, Johann Wolfgang Döbereiner començava a formular intents de classificació dels elements, i el 1828 proposava una sèrie de triades, entre les quals hi havia la formada pel liti, el sodi i el potassi. Döbereiner computava que el pes atòmic del sodi, d’acord amb les taules de Berzelius, coincidia amb la mitjana dels pesos atòmics del liti i del potassi. Aquesta relació apareix en sistemes dels elements posteriors, com la “Vis tellurique” d’Alexandre-Émile Béguyer de Chancourtois, publicada en el 1863. En el 1865, John Newlands, amb la llei d’octaus, parlava d’un grup d’elements integrat pel liti, el sodi, el potassi, el coure, el rubidi, l’argent, el cessi i l’osmi.
”
En el 1869, amb la “taula periòdica” de Mendeleev, aquests intents començaven a prendre força. El potassi, amb un pes atòmic de 39, apareix en el tercer període del grup encapçalat pel liti i el sodi. Aquest grup passaria a rebre la denominació de grup I, i a ser caracteritzat per la fórmula general dels seus òxids, R2O, que en el cas del potassi conduïa a l’òxid de dipotassi (K2O).

Lothar Meyer, en el 1870, de manera independent a Mendeleev, havia remarcat que si hom relaciona en un gràfic la massa atòmica i el volum atòmic, pot fer-se una idea de periodicitat dels elements. El potassi, amb un volum atòmic de 50 cm3, és únicament superat pel rubidi. Meyer remarcà quatre pics principals: heli, sodi, potassi i rubidi, corresponents, d’altra banda, amb els quatre períodes de la taula de Mendeleev
Fins ben entrada la segona meitat del segle XIX, quan la demanda de sals potàssiques en l’agricultura ja havia experimentat un fort creixement, la font del potassi continuava ésser vegetal, especialment cendres de fusta d’avet. Hom coneixia a Europa ja minerals potàssics (la silvita, KCl, havia estat descrita el 1832 al Mt. Vesuvi), però la seva explotació era menor. Això canvià a partir del 1861, amb la descoberta de dipòsits de clorur potàssic (Kalisalze), prop de Staßfurt (Saxònia prussiana). En aquest districte, conegut com a Salzland, s’explotava des de feia uns anys sal sòdica, i ja en 1856, Rudolf von Carnall havia descrit la carnal•lita (un clorur de potassi i magnesi). El dipòsit de potassa fou investigat i, a partir del 1868, amb els estudis d’Oskar Kordel (1868) i Karl Birnbaum (1869), les fonts minerals de potassi guanyaren pes per damunt de les vegetals.

Una mostra d’halita, constituïda bàsicament per clorur potàssic, d’un dipòsit de Stassfurt
D’especial interès també era el salpetre, constituït bàsicament per nitrat potàssic (KNO3), i explotat especialment com a font de N per a la confecció de fertilitzants i de grups –NO3 per a la confecció d’explosius.

En el 1912 es descobriren a Súria jaciments de sals potàssiques. L’explotació de la silvita (KCl) i de la carnal•lita (KMgCl3•6H2O) han marcat la història econòmica de la població. Encara que Iberpotash, S.A. (fotografia d’instal•lacions), també produeix clorur sòdic, la producció estratègica és la del clorur potàssic, com mostra el fet que aquesta companyia formi part de la divisió de “Fertilizers” de ICL. La demanda desigual dels diferents materials extrets ha suposat l’acumulació de runam salí (format majoritàriament per NaCl) durant dècades, amb els consegüents problemes ambientals
El potassi: isòtops i abundància
La massa atòmica estàndard del potassi es calcula en 39,0983, valor que deriva de la mitjana ponderada dels seus isòtops, fonamentalment del 39K. En tot cas, un llistat dels isòtops coneguts seria:
– potassi-32 (32K; 32,02192 uma). Nucli format per 19 protons i 13 neutrons. És un isòtop molt inestable, que decau a argó-31 (amb emissió d’un protó). Posseeix un estat metastable (32mK) de 950 keV.
– potassi-33 (33K; 33,00726 uma). Nucli format per 19 protons i 14 neutrons. És un isòtop molt inestable, amb una semivida inferior a 2,5•10-8 s. Decau a argó-32, amb emissió d’un protó.
– potassi-34 (34K; 33,99841 uma). Nucli format per 19 protons i 15 neutrons. És un isòtop molt inestable, amb una semivida inferior a 2,5•10-8 s. Decau a argó-33, amb emissió d’un protó.
– potassi-35 (35K; 34,988010 uma). Nucli format per 19 protons i 16 neutrons. És un isòtop molt inestable, amb una semivida de 0,178 s. Decau normalment (99,63%) a argó-35 (amb emissió d’un positró) o, alternativament (0,37%) a clor-34 (amb emissió d’un protó i d’un positró).
– potassi-36 (36K; 35,981292 uma). Nucli format per 19 protons i 17 neutrons. És un isòtop molt inestable, amb una semivida de 0,342 s. Decau normalment (99,94%) a argó-36 (amb emissió d’un positró) o, alternativament, a clor-35 (0,048%; amb emissió d’un protó i d’un positró) o a sofre-32 (amb emissió d’un nucli de 4He i d’un positró).
– potassi-37 (37K; 36,97337589 uma). Nucli format per 19 protons i 18 neutrons. És un isòtop inestable, amb una semivida de 1,226 s. Decau a argó-37, amb emissió d’un positró.
– potassi-38 (38K; 37,9690812 uma). Nucli format per 19 protons i 19 neutrons. És un isòtop inestable, amb una semivida de 458,2 s (7 minuts i 38 segons). Decau a argó-38, amb emissió d’un positró. Posseeix dos estats metastables, un de 130,5 keV (38m1K; amb una semivida de 0,9242 s) i un altre de 3458,0 keV (38m2K; amb una semivida de 2,198•10-5 s).
– potassi-39 (39K; 38,96370668 uma). Nucli format per 19 protons i 20 neutrons. És un isòtop estable. És l’isòtop majoritari de potassi, amb una abundància relativa de 93,2581%.
– potassi-40 (40K; 39,96399848 uma). Nucli format per 19 protons i 21 neutrons. És un isòtop inestable, per bé que amb una semivida prou llarga, de 3,938•1016 s (1248 milions d’anys). Decau majoritàriament (89,28%) a calci-40 (amb emissió d’un electró) o, alternativament a argó-40 (10,72% per captura electrònica; 0,001% amb emissió d’un positró). Posseeix un estat metastable (40mK) de 1643,639 keV, amb una semivida de 3,36•10-7 s. L’abundància relativa actual a la litosfera terrestre de 40K és de 0,0117%. Isòtop radioactiu primordial a la Terra, el contingut de 40K ha davallat al 8% de la dotació originària; la seva descomposició és la responsable de la concentració relativament elevada d’argó (40Ar, isòtop radiogènic) que trobem en l’atmosfera terrestre (i també en les atmosferes d’altres planetes rocallosos). Aquesta transformació de 40K a 40Ar és la base de diversos mètodes de datació radiomètrica. S’aplica sobretot a la datació de minerals i roques de més de 100.000 d’antiguitat (el temps mínim necessari perquè el potassi-40 de les roques doni una concentració suficient d’argó-40 retingut), i en aquest sentit és important en la datació arqueològica (Olduvai Gorge, Hadar). Aquest mètode de datació s’ha emprat per construir l’escala temporal de polaritat geomagnètica (GPTS), que abasta la història del camp magnètic terrestre dels darrers 83 milions d’anys. El 40K també és emprat en estudis de traçabilitat en processos biogeoquímics.
– potassi-41 (41K; 40,96182576 uma). Nucli format per 19 protons i 22 neutrons. És un isòtop estable, amb una abundància relativa del 6,7302%.
– potassi-42 (42K; 41,96240281 uma). Nucli format per 19 protons i 23 neutrons. És un isòtop inestable, amb una semivida de 4,4496•104 s (12 hores). Decau a calci-42, amb emissió d’un electró.
– potassi-43 (43K; 42,960716 uma). Nucli format per 19 protons i 24 neutrons. És un isòtop inestable, amb una semivida de 8,03•105 s (22 hores). Decau a calci-43, amb emissió d’un electró.
– potassi-44 (44K; 43,96156 uma). Nucli format per 19 protons i 25 neutrons. És un isòtop inestable, amb una semivida de 1328 s (22 minuts). Decau a calci-44, amb emissió d’un electró.
– potassi-45 (45K; 44,960699 uma). Nucli format per 19 protons i 26 neutrons. És un isòtop inestable, amb una semivida de 1040 s (17 minuts). Decau a calci-45, amb emissió d’un electró.
– potassi-46 (46K; 45,961977 uma). Nucli format per 19 protons i 27 neutrons. És un isòtop inestable, amb una semivida de 105 s. Decau a calci-46, amb emissió d’un electró.
– potassi-47 (47K; 46,961678 uma). Nucli format per 19 protons i 28 neutrons. És un isòtop inestable, amb una semivida de 17,50 s. Decau a calci-47, amb emissió d’un electró.
– potassi-48 (48K; 47,965514 uma). Nucli format per 19 protons i 29 neutrons. És un isòtop inestable, amb una semivida de 6,8 s. Decau normalment (98,86%) a calci-48 (amb emissió d’un electró) o, alternativament (1,14%) a calci-47 (amb emissió d’un neutró i d’un electró).
– potassi-49 (49K; 48,96745 uma). Nucli format per 19 protons i 30 neutrons. És un isòtop inestable, amb una semivida de 1,26 s. Decau majoritàriament (86%) a calci-48 (amb emissió d’un neutró i d’un electró) o, alternativament (14%) a calci-49 (amb emissió d’un electró).
– potassi-50 (50K; 49,97278 uma). Nucli format per 19 protons i 31 neutrons. És un isòtop molt inestable, amb una semivida de 0,472 s. Decau majoritàriament (71%) a calci-50 (amb emissió d’un electró) o, alternativament (29%) a calci-49 (amb emissió d’un neutró i d’un electró).
– potassi-51 (51K; 50,97638 uma). Nucli format per 19 protons i 32 neutrons. És un isòtop molt inestable, amb una semivida de 0,365 s. Decau bé a calci-51 (53%; amb emissió d’un electró) o bé a calci-50 (47%; amb emissió d’un neutró i d’un electró).
– potassi-52 (52K; 51,98261 uma). Nucli format per 19 protons i 33 neutrons. És un isòtop molt inestable, amb una semivida de 0,105 s. Decau majoritàriament (64%) a calci-51 (amb emissió d’un neutró i d’un electró) o, alternativament, a calci-50 (21%; amb emissió de dos neutrons i d’un electró) o a calci-52 (15%; amb emissió d’un electró).
– potassi-53 (53K; 52,98712 uma). Nucli format per 19 protons i 34 neutrons. És un isòtop molt inestable, amb una semivida de 0,030 s. Decau majoritàriament (67%) a calci-52 (amb emissió d’un neutró i d’un electró) o, alternativament, a calci-51 (17%; amb emissió de dos neutrons i d’un electró) o bé a calci-53 (16%; amb emissió d’un electró).
– potassi-54 (54K; 53,99420 uma). Nucli format per 19 protons i 35 neutrons. És un isòtop molt inestable, amb una semivida de 0,010 s. Decau normalment (>99,9%) a calci-54 (amb emissió d’un electró) o, alternativament (<0,1%) a calci-53 (amb emissió d’un neutró i d’un electró).
– potassi-55 (55K; 54,99971 uma). Nucli format per 19 protons i 36 neutrons. És un isòtop molt inestable, amb una semivida de 0,003 s. Decau bé a calci-55 (amb emissió d’un electró) o bé a calci-54 (amb emissió d’un neutró i d’un electró).
– potassi 56 (56K). Nucli format per 19 protons i 37 neutrons. És un isòtop molt inestable.
L’àtom neutre de potassi conté 19 electrons, amb una configuració basal d’escorça de 1s22s22p63s23p64s1. És el primer element del quart període, integrat en el grup dels metalls alcalins (grup 1 o IA, o també conegut com a grup del liti). L’estat d’oxidació més habitual és +1 (K+; òxid fortament bàsic), per bé que també pot presentar -1 (K–). Presenta un radi de Van der Waals de 2,75•10-10 m.

El potassi, a la flama, emet una coloració lila característica (pic d’emissió a 766,5 nm). La coloració és el resultat de la reacció del K elemental amb l’oxigen i el vapor d’aigua de l’atmosfera. L’espectrometria de flama continua emprada en mètodes de detecció i quantificació de potassi
En condicions estàndards de pressió i de temperatura, es presenta com un sòlid metàl•lic. Amb una densitat de 862 kg•m3, és el segon metall menys dens a temperatura ambient (únicament superat pel liti). El potassi elemental és un material tou (0,4 en l’escala de Mohs) i fàcil de tallar. Els talls frescos tenen un aspecte argentí, que ràpidament s’apaga cap al gris, com a conseqüència de l’oxidació, en exposar-se a l’aire. El potassi elemental sòlid adopta una estructura cristal•lina cúbica centrada en el cos.

Potassi elemental conservat en forma de perles de 5 mm, embegudes en oli de parafina. En aquestes condicions, que el preserven d’oxidació, s’aprecia la tonalitat argentina, d’altra banda similar a la d’altres metalls alcalins. La reacció del potassi elemental amb l’aire és violentament exotèrmica, amb formació de peròxid de potassi (K2O2) i d’hidròxid (potassa càustica, KOH), i alliberament de gas H2.
En condicions estàndards de pressió, el sodi presenta un punt de fusió relativament baixa, a 336,7 K. La densitat del potassi elemental líquid en el punt de fusió és de 828 kg•m-3. La reactivitat amb l’aigua del potassi líquid fa que sigui emprat (com a tal, o en aliatge NaK) com a dessecant de solvents secs en processos de destil•lació.
El punt d’ebullició, a pressió estàndard, se situa a 1032 K.
La baixa energia d’ionització del potassi (418,8 kJ•mol-1) explica la seva reactivitat i que a la Terra el trobem, bé en forma iònica (K+) o formant compostos iònics (sals). La reactivitat del potassi (com la del sodi o la del liti) fou aprofitada per Reuben D. Rieke en la reducció de sals d’altres elements (p. ex., en l’obtenció del magnesi de Rieke: MgCl2 + 2 K → Mg + 2 KCl). L’alta energia d’hidratació de K+ el fa molt soluble en aigua (on forma complexos iònics [K(H2O)6-7]+). La reactivitat del KOH amb el CO2 (KOH + CO2 → K2CO3 + H2O) s’empra en l’eliminació química de CO2 en l’aire.

Estructura química del tetrafenilborat sòdic, un dels agents emprats en la precipitació del potassi en solucions aquoses. Altres agents emprats són l’àcid hexacloroplatínic (H2PtCl6) i el cobaltinitrit sòdic (CoN6Na3O12).
L’abundància relativa del potassi en l’univers ve condicionada pels processos nucleosintètics d’estels massius i supernoves de tipus IIa (a partir de la combustió de l’oxigen, del neó i del silici, i dels processos de captura neutrònica). Com s’esdevé amb els nucleons de nombre Z senar, l’abundància del potassi és relativament baixa. El superen, doncs, els dos elements que el flanquegen en la taula periòdica, tant l’argó com el calci. Dels elements de menor nombre atòmics, únicament són més abundants el fluor, el liti, el bor i el beril•li. Dels elements de nombre atòmic superior, a banda del calci, també són més abundants que el potassi, el crom, el manganès, el ferro i el níquel.
En el Sistema Solar, per cada àtom de potassi, n’hi ha centenars d’àtoms de silici. Com a element litòfil que és, les majors concentracions les trobem en els planetes rocallosos.
Globalment, en la Terra, l’abundància atòmica del potassi és de 110 ppm que, en termes de massa, suposen 160 ppm. La concentració màxima s’ateny en l’escorça terrestre, on en termes de massa el potassi suposa el 2,6%, superat tan sols pels altres principals elements formadors de roca: l’oxigen, el silici, l’alumini, el ferro, el calci i el sodi. En algunes formacions rocoses, el percentatge de potassi és superior, com és en el cas dels granits (5%). Quantitativament, podem esmentar entre els minerals formadors de roques ígnies, l’ortosa (o ortoclasa, també coneguda com a feldespat de potassi, KAlSi3O8).

Espècimen d’ortosa de Minas Gerais, Brasil. Aquest mineral tectosilicat és constituent habitual de molts granits i d’altres roques ígnies. La mineria del potassi, no obstant, recolza en els dipòsits evaporítics
La producció de potassi depèn, però, de dipòsits d’origen evaporític, formats arran de l’evaporació d’antigues masses marines. Entre els minerals de potassa podem esmentar la silvita (KCl), la carnal•lita (KCl•MgCl26H2O), la caïnita (MgSO4•KCl•3H2O) o la langbeinita (MgSO4•K2SO4). També són explotats els dipòsits de salnitre o salpetre (KNO3), que resulten de processos de descomposició aeròbia de matèria orgànica. La major part de la producció de sals de potassi es destina a la confecció de fertilitzants. Entre els usos industrials podem esmentar la saponificació de greixos i olis (amb KOH), la confecció d’explosius (KNO3), la metal•lúrgia (el KCN és emprat en la dissolució de coure, agent o or), la indústria del vidre (K2CO3), la panificació sense llevat (en la qual la sal de Rochelle, KNaC4H4O6 sol ser el principal component).
En la hidrosfera, els ions potassi (K+) són molt menys abundants que els ions sodi (Na+). En els oceans la relació és de 28:1, mentre que en la litosfera la relació és de 11:10. Així, en termes de massa, l’abundància oceànica del potassi és de 0,39 kg•m-3 (superada, a més de per l’oxigen i l’hidrogen, pel clor, el sodi, magnesi, el sofre i el calci).
La presència de potassi en l’atmosfera es limita a traces. És possible també detectar-ne la presències en les exosfera de planetes rocallosos com la Lluna (17 àtoms•cm-3) o Mercuri.
En la biosfera, el potassi constitueix un dels macroelements. És el principal ió intracel•lular per a tots els tipus cel•lulars coneguts. S’entén, doncs, que l’element fos descrit originàriament en potasses d’origen vegetal. La concentració diferencial de Na+ i K+ en els medis intracel•lular i extracel•lular és el principal factor en l’establiment d’un potencial electroquímic, essencial en la majoria dels sistemes de transport de substàncies a través de la membrana cel•lular. El caràcter del K+ com el catió monovalent intracel•lular fa que les relacions Na:K que trobàvem en l’escorça terrestre o en el medi aquàtic s’inverteixin. En general, els organismes adopten estratègies de captació i retenció de K, alhora que estratègies d’eliminació i contenció davant de Na. Com de comuna és la regulació del K entre els més diferents organismes, es manifesta per exemple en el fet que les principals proteïnes-canal de potassi que trobem en els mamífers (KcsA, KirBac1.1, KirBac3.1, KvAP i MthK) poden ésser relacionades amb els canals de potassi que trobem en bacteris.
La polaritat de concentracions de sodi i de potassi a través de la membrana cel•lular, pròpia de tots els organismes, s’aconsegueix a través de mecanismes actius de bombeig
En el cos humà, el potassi és el setè element més abundant en termes de massa (0,25%; superat pels quatre grans: O, C, H i N; i pel Ca, el P i el S). En termes atòmics, en suposa el 0,033%. La concentració intracel•lular de potassi és típicament de 150 mmol•L-1. Hom calcula que en un cos humà de 70 kg, amb una quantitat total de 140 grams de potassi, hi ha 4400 desintegracions de 40K per segon, la qual cosa el converteix en la font més gran de radioactivitat natural endògena, per damunt i tot de la del carboni-14. Sobre la radioactivitat natural del potassi (31 Bq•g-1) i dels aliments que en contenen, Ashley Brown proposa una interessant lliçó pràctica.
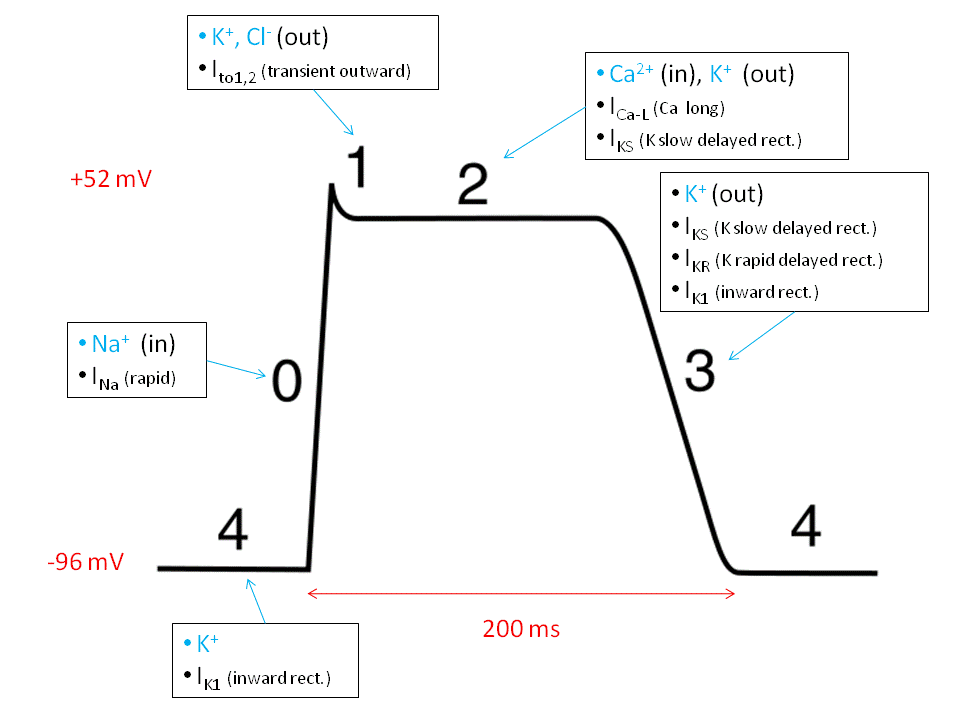
El batec cardíac és el resultat agregat de la contracció de les cardiomiòcits (les fibres musculars del cor). La contracció és desencadenada per l’augment transitori de la concentració de Ca2+ i, en aquest procés, els canals de K+ tenen gran rellevància. Dosis intravenoses de KCl de 10-20 mEq/hora, emprades en procediments d’injecció letal als Estats Units, desencadenen una aturada cardíaca en impedir la repolarització de la membrana de les cèl•lules cardíaques
La ingesta diària mitjana recomanable de potassi per a l’humà adult és de 2-4 g. El potassi, a baixa concentració, té una sabor dolça, però a concentracions més elevades té una sabor més amarga i salada. En tot cas, contribueix de forma menor a la sabor dels aliments que més en contenen (cereals sencers, carn, llegums, fruites, verdures). La major part del potassi ingerit és absorbit en el tub digestiu. En condicions normals, l’excreció de potassi, a través de l’orina, es regula per tal de mantindre’n els nivells interns. Els nivells plasmàtics de potassi (típicament de 4,8 mmol•L-1) també són regulats per l’absorció tissular, principalment per part de la musculatura i del fetge.
Entre les funcions fisiològiques que més depenen del potassi podem esmentar la regulació de l’excitabilitat neuromuscular, la formació de glucogen, la síntesi proteica, la regulació de l’equilibri àcid-base i electrolític, etc. L’estret vincle entre el cations K+, Na+ i els hidrogenions (H3O+) es manifesta en els elements de regulació comuna. Així, l’aldosterona estimula la reabsorció renal de sodi i l’excreció renal de potassi; en situacions d’acidosi, hi ha una tendència a l’elevació de la concentració de potassi en els fluids extracel•lulars, i la inversa en situacions d’alcalosi. Les situacions agudes de depleció de potassi en l’organisme humà poden deure’s a un excés d’excreció urinària, gastrointestinal (com a conseqüència de vòmits o diarrees) o cutània (en l’exercici extenuant o en situacions d’elevada sudoració).
El potassi en la fertilització de sòls

La deficiència en potassi pot manifestar-se en les fulles amb l’aparició de taques porpres (foto) o en la clorosi entre venes. La deficiència afecta negativament el creixement, arrelament i fructificació de les plantes. Com que és un nutrient mòbil, que tendeix a ésser transportat cap a les parts més joves, els símptomes de la deficiència apareixen primer en les fulles i talls més vells.
La rellevància de la deficiència de potassi ja fou posada de manifest per la química agrícola de les primeres dècades del segle XIX. Entre els cultius més típicament afectats podem esmentar les patates, la col, la tomata, la remolatxa o molts cereals. Els sòls que més fàcilment presenten una quantitat deficient de potassi són els més sorrencs i els menys densos, perquè és més fàcil la pèrdua de cations K+ per lixiviació. Però també passa en sòls més densos que siguin pobres en argiles, o en sòls argilosos poc estructurats/agregats.
Entre les funcions de la fisiologia vegetal que més depenen del potassi podem esmentar la síntesi de proteïnes, la síntesi de paret cel•lular, la fotosíntesi, el transport de soluts pel floema (sàvia elaborada), la regulació dels estomes foliars i, en general, els processos vinculats a l’equilibri hídric i electrolític de les cèl•lules vegetals.
Segons les espècies, la collita té un contingut de potassi (expressat en K2O) del 0,5%-2%. La deficiència en potassi, fins i tot quan no presenta símptomes directes, pot comportar una major susceptibilitat dels cultius a danys ambientals (glaçades) o biològics (plagues). Quan és més fonda, els efectes ja són directament deguts a disfuncions per uns nivells insuficients de potassi. A banda de la suplementació de potassi en el sòl, una altra estratègia pot ésser la utilització de varietats que siguin més eficients en la captació de K+.
En els fertilitzants d’ús agrícola, el potassi és, després del nitrogen i del fòsfor, l’element químic més rellevant. El 95% de la producció de sals de potassi (potasses) es destina a la confecció de fertilitzants. El 90% del potassi dels fertilitzants químics emprats es troba en forma de KCl (que, en la indústria de la potassa encara rep el nom clàssic de muriat de potassi o MOP). Altres sals emprades són el sulfat (K2SO4, indicat per a suplementar cultius sensibles al Cl–) i, ja en molta menor mesura, el nitrat (KNO3). Sense aquests fertilitzants, els sòls agrícoles sotmesos a les tècniques modernes, perdrien, collita rere collita, les reserves d’ions K+.
A mitjan del segle XIX, la principal font del potassi per a fertilitzants s’obtenia encara de les cendres d’avets, que constituïen una de les principals exportacions industrials del Canadà. Els dipòsits de Saxònia, que començaren a ser explotats en els anys 1860s, corresponen a evaporites del Permià mitjà i tardà (270-250 milions d’anys d’antiguitat), de la formació Zechstein. En els anys 1950, hom començà a explotar els dipòsits de Saskatchewan, de la formació Elk Point Group, que data del Devonià mitjà (fa 390 milions d’anys). En les darreres dècades, hom ha investigat d’aprofitar el potassi procedent de les plantes salines marítimes (p.ex., un projecte del TIFAC del 2002), però tan sols les de la Mar Morta fan producció comercial de potassi (3,4 milions de tones anuals).
El 70% de la producció actual de potassa depèn de tres càrtels, Canpotex (Canadian Potash Exporters), Belaruskali (centrada a Bielorússia) i Uralkali (centrada a Rússia). Les fluctuacions de preus de la potassa són degudes a canvis en aquestes estructures empresarials (p. ex., les relacions entre Uralkali i Belaruskali) i a les fluctuacions de demanda. La producció mundial de potassa és de vora 40 milions de tones (més d’un 25% canandenques) i les reserves estimades aprofitables són de 9500 milions de tones (gairebé la meitat al Canadà).

Mostra de “Patentkali”, un dels fertilitzants de potassi, obtingut a partir de la langbeinita, i que consisteix en sulfats de magnesi i de potassi amb una relació estequiomètrica de Mg:K aproximada d’1:2