El fets dels darrers anys a Gran Bretanya, des de la commemoració en el 2007 del Tricentenari de la Llei de la Unió que establí la unió dels regnes anglès i escocès, fins a la recent celebració d’un referèndum en el qual Escòcia rebutjà la possibilitat de recuperar la independència, han generat una producció historiogràfica que divulga, revisa, discuteix, els fets del passat. L’evolució política del parlamentarisme des del 1688, l’auge i recés de l’imperialisme britànic, les lluites de classes i els canvis socials profunds i la mateixa relació entre les ‘home nations’, han estat arena de combat per a les diverses escoles i tendències. La qüestió de distingir entre allò britànic i allò que cal veure a nivell anglès, escocès, gal•lès o còrnic, és matèria de controvèrsia. Prenguem per exemple la categoria “Scottish Enlightenment”. És una expressió ben present en la historiografia escocesa (p.ex. “The Scottish Enlightenment”, d’Alexander Broadie, del 1997), però d’altres autors l’analitzen en un context britànic i àdhuc europeu (a cavall de la “revolució científica” i de la “revolució industrial”). Gairebé tots els autors associats a aquest terme escrigueren en llengua anglesa (Francis Hutcheson, David Hume, Adam Smith, Dugald Stewart, Thomas Reid, Robert Burns, Adam Ferguson, John Playfair, Joseph Black o James Hutton), amb el marc britànic (de Gran Bretanya o de les Illes Britàniques) al cap, i deixarien una petjada també en l’Amèrica anglòfona i en el continent europeu. Tot i amb tot, les arrels escoceses hi són. La Unió amb Anglaterra suposà la fi del Parlament escocès, però el dret escocès fou preservat, de manera que Edinburgh es transformà de capital política típica a una capital jurídica. D’altra banda, la querella entre episcopalians i presbiterians, deixà els afers esclesiàstics escocesos a mans dels darrers, de forma que l’Església d’Escòcia establerta i majoritària fou separada i excomunicada respecte de la d’Anglaterra. Edinburgh, a més de capital jurídica i teològica, mantingué i acresqué la universitat fundada en el 1583 també en els altres aspectes, de filosofia seglar, d’economia política, de medicina, de ciències naturals, d’enginyeria. Hom associa la il•lustració escocesa amb l’empirisme de Hume (1717-1776) i amb el realisme del sentit comú de Thomas Reid (1710-1796). Amb llum pròpia llueix Adam Smith, fundador de l’economia moderna amb “An Inquiry into the Nature and Causes of the Wealth of Nations” (1776). Però l’interès historiogràfic en les darreres dècades, i òbviament el que més ens pertoca en aquesta sèrie nostra té a veure amb el món de les ciències naturals i de la química en particular. En el seu moment ja vam parlar de Joseph Black (1728-1799), però també podem recordar la figura de William Cullen (1710-1790) o la del fundador de la geologia moderna, James Hutton (autor de “Theory of the Earth”, 1795). La il•lustració escocesa connecta amb la revolució industrial, ni que sigui perquè pensem en James Watt (1736-1819) i la seva màquina de vapor. És cert que Anglaterra serà la seu de la revolució industrial, on prosperaran els grans centres industrials i es forjarà el primer proletariat modern. Però fins ben entrat el segle XIX, en el món de la ciència i de la tècnica, els representants de l’antiga Caledònia hi abundaran de manera desproporcionada a la població, territori i riquesa del seu desaparegut reialme. Nosaltres, en tot cas, arribem al nombre 38 de la nostra sèrie.

Esquema de la màquina de vapor de Boulton & Watt, del 1784. Si James Watt era fill d’una família naviera de Greenock (Renfrewshire, Firth of Clyde, Escòcia), el seu soci Mathew Boulton era fill d’un petit empresari joguiner de Birmingham (Anglaterra). La màquina de vapor de Watt & Boulton no fou ni la primera ni la definitiva, però ocupa un lloc icònic pel fet de fornir el moviment rotatiu continu que facilitava la seva aplicació per fornir energia a les indústries mecanitzades més diverses. La rellevància de la tecnologia la posa de manifest Engels quan diu que “El proletariat s’originà durant la revolució industrial, que tingué lloc a la darrera meitat del segle passat a Anglaterra, i que des d’aleshores s’ha repetit en tots els països civilitzats del món. Aquesta revolució industrial fou precipitada per la descoberta de la màquina de vapor, de diverses filadores mecàniques, del teler mecànic i de tota una sèrie d’altres dispositius mecànics. Aquestes màquines, que eren molt cares i per tant sols les podien comprar els grans capitalistes, alteraren tot el sistema de producció i desplaçaren els antics treballadors, perquè les màquines produïen mercaderies més barates i millors que les que podien produir els obrers amb les ineficients filadores i telers manuals.”
William Cruickshank i la descoberta de l’estronci

La trajectòria de William Cruickshank ens recorda a la d’altres figures de l’anomenada Il•lustració Escocesa. Era cirurgià de professió, diplomat al Col•legi de Cirurgians d’Anglaterra, el 5 d’octubre del 1780. Serví en l’exèrcit en aquesta condició de cirurgià amb diferents destinacions, fins que el març del 1788 fou nomenat ajudant d’Adair Crawford en la Royal Military Academy de Woolwich.
Adair Crawford tenia en aquella època quaranta anys. Havia nascut a Belfast, però s’havia format a les universitats de Glasgow i Edinburgh, on es graduà en medicina. A la Royal Military Academy era professor de química, ocupació que compaginava amb la de metge del St Thomas’ Hospital, al centre de Londres.

Peça d’estroncianita, procedent de la localitat tipus, Stronian (Argyllshire), en les Terres Altes del nord-oest d’Escòcia
Interès comú de Cruickshank i de Crawford era la mineralogia i, en especial la química mineralògica a la llum dels paradigmes moderns de la química elemental. Des del 1787, per exemple, Cruickshank sospitava que un rar mineral de la seva col•lecció, procedent d’una mina de plom de Strontian (Sròn an t-Sìthein), al comtat d’Argyle, contenia una substància elemental específica i prèviament no descrita. Cruickshank i Crawford sotmeteren aquest material a diferents proves, consignant per exemple, l’emissió d’una flama rogenca en cremar-lo. Crawford tenia experiència en els “heavy spars” i en aïllar-hi la substància elemental que els era més característica, la barita. Però aquest material no encaixava en el concepte de barita, ni que fos pel menor pes específic que presentava. En un article publicat a “Medical Communications” en el 1790, “On the Medicinal Properties of the Muriated Barytes”, Crawford descrigué el mineral tot proposant que contenia una substància elemental prèviament desconeguda:
“És de fet probable, que en el mineral escot sigui una nova espècie de terra que no ha estat fins ara suficientment examinada”.
El també metge Friedrich Gabriel Sulzer (*Gotha, 10.10.1749) s’interessà per la descoberta i afegí a la seva apreciable col•lecció de minerals una mostra del misteriós “mineral escocès” descrit per Crawford. L’investigà al costat del seu col•lega, Johann Friedrich Blumenbach (*Gotha, 11.5.1752).

Johann Friedrich Blumenbach (1752-1840) és conegut sobretot per la seva tesi doctoral “De generis humani varietate nativa” i per obres posteriors on proposà una taxonomia racial per a l’espècie humana en sis grups: “caucasiana”, “mongoliana”, “malaia”, “etíop” i “americana”.
En un article publicat en el 1791, al Bergmännisches Journal, Sulzer i Blumenbach denominen el mineral escocès (Schottisches Foßil) “estroncianita” (Strontianite) i assenyalen que, efectivament, podria contindre una nova terra (Grunderde).

Thomas Charles Hope (1766-1844)
Qui també investigà el mineral des del 1791 fou Thomas Charles Hope (*Edinburgh, 21.7.1766), professor de química en la Universitat de Glasgow. En el 1794, Hope publicava una monografia al Transactions of the Royal Society of Edinburgh, en la qual reconeixia la prioritat de la descoberta a Crawford, afegint:
“Considerant-la una terra peculiar, vaig creure necessari donar-li un nom. L’he anomenat estroncita (Strontites), del lloc on fou trobada; una manera de derivar, en la meva opinió, tan plenament pròpia com la de qualsevol qualitat que pugui posseir, tal com és l’estil actual”.
En triar la referència al lloc de descripció, tal com havien fet Sulzer i Blumenbach, Hope s’estalviava la temptació de donar-li un nom més complex, com ara el de “barita airejada”, que a més podria conduir a confusions amb la barita o “witherita”.
En el 1794 arribava a la Royal Military Academy de Woolwich, John Rollo, flamant cirurgià general de l’Artilleria Reial. Rollo, excel•lent patòleg, era el cas de les descobertes de Matthew Dobson (1732-1784) sobre la diabetis, que associaven si més no una bona part dels casos de diabetis a uns elevats nivells de sucre en l’orina (glucosúria). Sembla que fou Rollo en parlar, doncs, de la “diabetes mellitus”, amb el quadre clàssic de poliúria, polidípsia i polifàgia, associada a un trastorn metabòlic del sucre. Així, davant d’un oficial que presentava aquesta malaltia, el posà amb una dieta de carn, bo i reduint dràsticament el sucre en la ingesta, registrant una millora dels símptomes, tal com comunicà a “Notes of a Diabetic Case” (1797). William Cruickshank s’afegí a les investigacions del seu col•lega i superior, i amb ell col•laborà en l’anàlisi química de l’orina en “An Account of Two Cases of the Diabetes Mellitus” (1798). En aquesta obra, Cruickshank fa la que es considera la primera descripció de l’aïllament de la urea, com a metabòlit principal de l’orina. Una altra col•laboració mèdica remarcable de Rollo & Cruickshank fou un tractament antisifilític experimental amb àcids.

Alguns instruments d’Adair Crawford, segons una il•lustració d’una de les seves darreres obres, “Experimental Enquiry into the Effects of Tonics and Other Medicinal Substances on the Cohesion of Animal Fiber”. Encara més coneguts són els seus estudis sobre calor animal, publicats en el 1779 (“Experiments and Observations on Animal Heat”), on forneix noves evidència sobre la identitat, ja proposada per Lavoisier, entre la combustió i la respiració animal. Crawford es moriria a 47 anys, el 29 de juliol del 1795
En el 1800, Cruickshank modificà la pila d’Alessandro Volta. Per comptes de col•locar els discs alternats de zinc i de coure en una pila vertical, Cruickshank els col•loca en una bateria de través (“through battery”), sostinguts per una capsa rectangular que impedia la fuita del líquid conductor. Hom ha suposat que aquests i altres experiments químics podien ser al darrera del seu deteriorament de la salut, especialment a partir del març del 1803. El 6 de juliol del 1804, es retirà amb una pensió d’invalidesa de 10 xílings diaris. Retornà a l’Escòcia natal, on es va morir devers l’any 1811.

Through battery
El caràcter de substància elemental de l’estroncita semblava ben establert, però com en el cas d’altres terres alcalines, magnèsia, calcita, barita, els experiments electroquímics de Humphry Davy revisarien la qüestió. En una conferència pronunciada el 30 de juny del 1808 a la Royal Society i publicada després al Philosophical Transactions, anunciava com aquestes terres alcalines eren realment compostos. Les substàncies simples eren els metalls que eren a la base de les terres corresponents. Així naixia la noció de “metall alcalino-terri”. L’estroncita o estroncianita era la terra alcalina corresponent al metall estronci (“strontium”), emprant la terminologia suggerida per Davy. Concretament, Davy havia descompost elèctricament una amalgama de la sal muriàtica d’estronci (clorur d’estronci en la terminologia de Davy) amb òxid de mercuri, obtenint el metall pròpiament denominat com a estronci.

Humphry Davy (1779-1829)
La proposta terminològica de Davy fou ràpidament acceptada. La trobem ja en el “New System of Chemical Philosophy” de John Dalton, en la qual, l’estronci apareix en una llista de 36 elements, concretament en el nombre 31, just després del potassi, del sodi, del calci, del magnesi i del bari. Dalton empra una simbologia de cercles per als seus elements. En el cas de l’estronci dibuixa quatre radis incomplets (que no arriben al centre).

En el n.31 veiem el símbol químic que Dalton assigna a l’estronci (strontium). Amb algunes excepcions i amb les adaptacions fonètiques i ortogràfiques corresponents, aquest nom, fixat per Davy, apareix en les diferents llengües
Els símbols químics que fem servir actualment deriven d’una obra del 1813. A l’estronci, d’acord amb el nom llatí de “strontium” no li podia correspondre la S, reservada al sofre, ni la St, reservada a l’stibium (l’antimoni). Així, li correspongué el símbol Sr. Posteriorment, l’antimoni passà al símbol Sb, per evitar confusions amb l’estany (stannum, que prengué el símbol de Sn), de manera que St ha quedat orfe.
Ja des dels temps de la descoberta de la barita i de l’estroncita, hom era conscient de les característiques compartides entre els elements de les terres alcalines, fossin pesades com les dues citades, o lleugeres com la magnèsia i la calcita. Amb Davy, el llistat de metalls alcalino-terris havia quedat fixat en beril•li, magnesi, calci, estronci i bari. Des del 1817 aquesta comunitat d’elements era una de les bases de Johann Wolfgand Döbereiner per a formular possibles classificacions del nombre ja creixent (gairebé mig centenar) d’elements coneguts. En el 1829 enumerava, entre diferents tríades d’elements, la formada pel calci, l’estronci i el bari. A més de les propietats comunes, entre aquests elements hi havia una proporció de pesos atòmics, ja que el pes atòmic de l’estronci (88) era igual al de la mitjana aritmètica dels pesos del calci (40) i del bari (136).
Una de les primeres aplicacions pràctiques de l’estronci la representa una patent del 1849 d’Augustin-Pierre Dubrunfaut (1797-1881) sobre l’ús de l’hidròxid d’estronci (Sr(OH)2) en el procés de cristal•lització del sucre de la remolatxa sucrera.
La sistematització dels elements continuava. En el 1859, Jean-Baptiste Dumas (1800-1884) feia, per exemple, un paral•lel entre els quatre metalls alcalino-terris (Mg, Ca, Sr, Ba) i els quatre no-metalls halògens (F, Cl, Br, I). En la llei d’octaus de John Newlands (1865), l’estronci apareix assignat amb el nombre atòmic de 31, com el cinquè element del grup del “glucini” (=beril•li), en el que apareixen també el magnesi, el calci, el zinc, el cadmi, el bari, el vanadi i el mercuri, tots caracteritzats per ésser elements normalment divalents.
Però la proposta més reconeguda seria la taula periòdica d’elements de Dmitri Mendeleev. En la taula del 1869, l’estronci, consignat amb pes atòmic de 87,6, apareix en el quart període, com a element del grup del calci (en el que també inclou el bari i el plom, en el cinquè i sisè períodes). En el 1871, però, fa un disseny més compacte de la taula. L’estronci passa al sisè període, dins del grup II. Més tard hom depurà aquest grup, separant-ne els metalls de transició (Zn, Cd, Hg), de manera que l’estronci adoptà ja definitivament la posició en el grup dels “alcalino-terris” com l’element del cinquè període.
L’ús de l’hidròxid d’estronci en la indústria sucrera no arrenca a gran escala fins entrada la dècada dels anys 1870, particularment a Alemanya. Això provocà un augment de la demanda d’aquesta substància. Malgrat el reciclatge del material al llarg del procés d’extracció de sucre, els productors havien de reposar la pèrdua. Les mines d’estroncianita (SrCO3) de Münsterland subministraren inicialment la matèria primera de l’hidròxid d’estronci, suplementades més tard, a partir del 1884, amb les mines de celestita (SrSO4) de Gloucestershire. Entrats els anys 1910, la indústria sucrera consumia anualment 100.000 tones de Sr(OH)2.
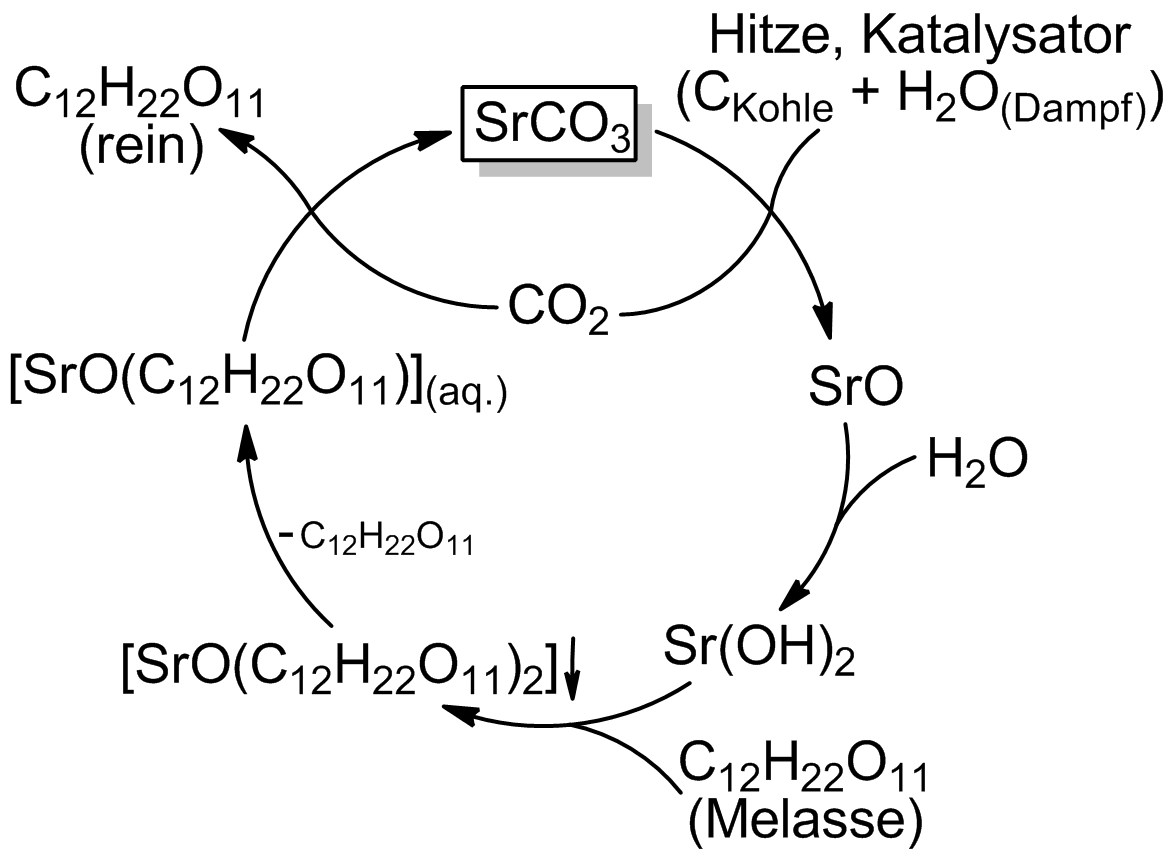
Procés estroncià per a l’extracció de sucre a partir de melassa. Ideat per Hippolyte Leplay i Augustin-Pierre Dubrunfaut, les millores de Carl Scheiber permeteren la seva aplicació a escala industrial, com va fer Emil Fleischer a la Refineria de Sucre de Dessau. A Münsterland hi va haver una autèntica febre per la mineria de l’estroncianita, truncada el 1883, per la competència amb la celestita d’Anglaterra, i per la tendència a la baixa del preu del sucre
Els tests atmosfèrics d’armes nuclears, iniciats el 16 de juliol del 1945, revelaren que l’estronci-90 era un dels productes de fissió nuclear de rendiment més elevat. El 90Sr és, alhora, un isòtop radioactiu. Bona part de les traces de 90Sr en mostres ambientals s’expliquen per aquests tests d’armes nuclears (que continuaren fins el 1980). La similitud química de l’estronci i del calci va provocar ja de bell antuvi preocupacions per una possible bioacumulació òssia de 90Sr.
L’estronci: isòtops i abundància
La massa atòmica estàndards de l’estronci és de 87,62 uma, valor que deriva de la mitjana ponderada dels isòtops més abundants. Un llistat complet del isòtops coneguts faria:
– estronci-73 (73Sr; 72,96597 uma). Nucli format per 38 protons i 35 neutrons. És un isòtop molt inestable, amb una semivida de poc més de 0,025 s. Decau normalment (>99,9%) a rubidi-73 (amb emissió d’un positró) o, alternativament (<0,1%), a criptó-72 (amb emissió d’un protó i d’un positró).
– estronci-74 (74Sr; 73,95631 uma). Nucli format per 38 protons i 36 neutrons. És un isòtop molt inestable, amb una semivida de 0,05 s. Decau a rubidi-74, amb emissió d’un positró.
– estronci-75 (75Sr; 74,94995 uma). Nucli format per 38 protons i 37 neutrons. És un isòtop molt inestable, amb una semivida de 0,088 s. Decau majoritàriament (93,5%) a rubidi-75 (amb emissió d’un positró) o, alternativament (6,5%), a criptó-74 (amb emissió d’un protó i d’un positró).
– estronci-76 (76Sr; 75,94177 uma). Nucli format per 38 protons i 38 neutrons. És un isòtop inestable, amb una semivida de 7,89 s. Decau a rubidi-76, amb emissió d’un positró.
– estronci-77 (77Sr; 76,937945 uma). Nucli format per 38 protons i 39 neutrons. És un isòtop inestable, amb una semivida de 9,0 s. Decau normalment (99,75%) a rubidi-77 (amb emissió d’un positró) o, alternativament (0,25%), a criptó-76 (amb emissió d’un protó i d’un positró).
– estronci-78 (78Sr; 77,932180 uma). Nucli format per 38 protons i 40 neutrons. És un isòtop inestable, amb una semivida de 159 s. Decau a rubidi-78 (amb emissió d’un positró).
– estronci-79 (79Sr; 78,929708 uma). Nucli format per 38 protons i 41 neutrons. És un isòtop inestable, amb una semivida de 135 s. Decau a rubidi-79 (amb emissió d’un positró).
– estronci-80 (80Sr; 79,924521 uma). Nucli format per 38 protons i 42 neutrons. És un isòtop inestable, amb una semivida de 6378 s (2 hores). Decau a rubidi-80 (amb emissió d’un positró)
– estronci-81 (81Sr; 80,923212 uma). Nucli format per 38 protons i 43 neutrons. És un isòtop inestable, amb una semivida de 1340 s (22 minuts). Decau a rubidi-81 (amb emissió d’un positró)
– estronci-82 (82Sr; 81,918402 uma). Nucli format per 38 protons i 44 neutrons. És un isòtop inestable, amb una semivida de 2,191•106 s (25 dies). Decau a rubidi-82, per captura electrònica.
– estronci-83 (83Sr; 82,917557 uma). Nucli format per 38 protons i 45 neutrons. És un isòtop inestable, amb una semivida de 1,167•105 s (32 hores). Decau a rubidi-83, amb emissió d’un positró. Posseeix un estat metastable (83mSr) a 259,15 keV, que té una semivida de 4,95 s, i que decau a l’estat basal.
– estronci-84 (84Sr; 83,913425 uma). Nucli format per 38 protons i 46 neutrons. Teòricament, decau a criptó-84 (amb emissió de dos positrons). La semivida però és tan llarga que, a efectes observacionals, és un isòtop estable. La seva freqüència és de 0,56%, amb oscil•lacions mostrals que va de 0,55% a 0,58%.
– estronci-85 (85Sr; 84,912933 uma). Nucli format per 38 protons i 47 neutrons. És un isòtop inestable, amb una semivida de 5,6017•106 s (65 dies). Decau a rubidi-85 per captura electrònica. Posseeix un estat metastable (85mSr) a 238,66 keV, que té una semivida de 4058 s i que decau a l’estat basal (86,6%) o directament a rubidi-85 (13,4%).
– estronci-86 (86Sr; 85,9092607309 uma). Nucli format per 38 protons i 48 neutrons. És un isòtop estable, amb una freqüència de 9,86% (que pot oscil•lar des de 9,75% a 9,99% segons la mostra). Posseeix un estat metastable (86mSr) a 2955,68 keV, que té una semivida de 4,55•10-7 s.
– estronci-87 (87Sr; 86,9088774970 uma). Nucli format per 38 protons i 49 neutrons. És un isòtop estable, amb una freqüència de 7,00% (que pot oscil•lar des de 6,94% a 7,14%). A la Terra, és en part un isòtop primordial i en part radiogènic, com a producte de la lenta desintegració (semivida de 49.000 milions d’anys) del rubidi-87. Per això és utilitzat en el mètode de datació de rubidi-estronci. La ratio 87Sr/86Sr oscil•la de valor de 0,7 a 4,0 en roques terrestres. Això la converteix en un paràmetre informatiu per identificar l’origen de sediments en ambients marins i fluvials, com feren Krom et al. (1999) per a la Mediterrània Oriental. En un sentit similar, aquesta ratio s’ha aplicat també en paleontologia per identificar migracions, o establir amb més certesa l’origen de materials arqueològics. Posseeix un estat metastable (87mSr) a 388,533 keV, que té una semivida de 1,013•104 s, i que decau bé a l’estat basal (99,7%) o, per captura electrònica (0,3%), a rubidi-87.
– estronci-88 (88Sr; 87,9056122571 uma). Nucli format per 38 protons i 50 neutrons. És un isòtop estable. És l’isòtop més freqüent d’estronci, amb una abundància relativa de 82,58% (que pot variar mostralment de 82,29% a 82,75%). És producte de la fissió d’isòtops radioactius pesants.
– estronci-89 (89Sr; 88,9074507 uma). Nucli format per 38 protons i 51 neutrons. És un isòtop inestable, amb una semivida de 4,369•106 s (51 dies). Decau a itri-89, amb emissió d’un electró. És producte de la fissió d’isòtops radioactius pesants. És emprat en el tractament de càncer ossi.
– estronci-90 (90Sr; 89,907738 uma). Nucli format per 38 protons i 52 neutrons. És un isòtop inestable, amb una semivida de 9,12•108 s (29 anys). Decau a itri-90, amb emissió d’un electró. És producte de la fissió d’isòtops radioactius pesants. Això explica que sigui present en una certa quantitat en els residus de centrals nuclears, com a producte de la fissió d’urani-235 (amb un rendiment del 5,7%), de l’urani-233 (amb un rendiment del 6,6%) i del plutoni-239 (amb un rendiment del 2,0%). Una altra font artificial la constitueixen les proves nuclears. El risc biològic s’explica per la seva tendència a acumular-se en biominerals (p.ex. la vida mitjana biològica en el cos humà seria de vora de 18 anys) o d’interferir amb teixits que retenen calci (p.ex. augmentant en humans el risc de patir paratiroidisme). Aquest tropisme vers els ossos fa que 89Sr i 90Sr siguin emprats en radioteràpia. 90Sr també té aplicacions com a traçador en recerca agronòmica. Alguns sistemes d’energia nuclear auxiliar (SNAP) empren 90Sr com a isòtop beta-radioactiu.
– estronci-91 (91Sr; 90,910203 uma). Nucli format per 38 protons i 53 neutrons. És un isòtop inestable, amb una semivida de 3,47•104 s (10 hores). Decau a itri-91, amb emissió d’un electró.
– estronci-92 (92Sr; 91,911038 uma). Nucli format per 38 protons i 54 neutrons. És un isòtop inestable, amb una semivida de 9580 s (3 hores). Decau a itri-92, amb emissió d’un electró.
– estronci-93 (93Sr; 92,914026 uma). Nucli format per 38 protons i 55 neutrons. És un isòtop inestable, amb una semivida de 445,4 s (7 minuts). Decau a itri-93, amb emissió d’un electró.
– estronci-94 (94Sr; 93,915361 uma). Nucli format per 38 protons i 56 neutrons. És un isòtop inestable, amb una semivida de 75,3 s. Decau a itri-94, amb emissió d’un electró.
– estronci-95 (95Sr; 94,919359 uma). Nucli format per 38 protons i 57 neutrons. És un isòtop inestable, amb una semivida de 23,9 s. Decau a itri-95, amb emissió d’un electró.
– estronci-96 (96Sr; 95,931697 uma). Nucli format per 38 protons i 58 neutrons. És un isòtop inestable, amb una semivida de 1,07 s. Decau a itri-96, amb emissió d’un electró.
– estronci-97 (97Sr; 96,926153 uma). Nucli format per 38 protons i 59 neutrons. És un isòtop molt inestable, amb una semivida de 0,429 s. Decau normalment (99,95%) a itri-97 (amb emissió d’un electró) o, alternativament (0,05%), a itri-96 (amb emissió d’un neutró i d’un electró). Posseeix dos estats metastables, un a 308,13 keV (97m1Sr; amb una semivida de 1,7•10-7 s) i un altre a 830,8 keV (97m2Sr; amb una semivida de 2,55•10-7 s).
– estronci-98 (98Sr; 97,928453 uma). Nucli format per 38 protons i 60 neutrons. És un isòtop molt inestable, amb una semivida de 0,653 s. Decau normalment (99,75%) a itri-98 (amb emissió d’un electró) o, alternativament (0,25%), a itri-97 (amb emissió d’un neutró i d’un electró).
– estronci-99 (99Sr; 98,93324 uma). Nucli format per 38 protons i 61 neutrons. És un isòtop molt inestable, amb una semivida de 0,269 s. Decau normalment (99,9%) a itri-99 (amb emissió d’un electró) o, alternativament (0,1%), a itri-98 (amb emissió d’un neutró i d’un electró).
– estronci-100 (100Sr; 99,93535 uma). Nucli format per 38 protons i 62 neutrons. És un isòtop molt inestable, amb una semivida de 0,202 s. Decau normalment (99,02%) a itri-100 (amb emissió d’un electró) o, alternativament (0,98%) a itri-99 (amb emissió d’un neutró i d’un electró).
– estronci-101 (101Sr; 100,94052 uma). Nucli format per 38 protons i 63 neutrons. És un isòtop molt inestable, amb una semivida de 0,118 s. Decau majoritàriament (97,63%) a itri-101 (amb emissió d’un electró) o, alternativament (2,37%), a itri-100 (amb emissió d’un neutró i d’un electró).
– estronci-102 (102Sr; 101,94302 uma). Nucli format per 38 protons i 64 neutrons. És un isòtop molt inestable, amb una semivida de 0,069 s. Decau majoritàriament (94,5%) a itri-102 (amb emissió d’un electró) o, alternativament (5,5%), a itri-101 (amb emissió d’un neutró i d’un electró).
– estronci-103 (103Sr; 102,94895 uma). Nucli format per 38 protons i 65 neutrons. És un isòtop molt inestable, amb una semivida de 0,05 s. Decau a itri-103, amb emissió d’un electró.
– estronci-104 (104Sr; 103,95233 uma). Nucli format per 38 protons i 66 neutrons. És un isòtop molt inestable, amb una semivida de 0,03 s. Decau a itri-104, amb emissió d’un electró.
– estronci-105 (105Sr; 104,95858 uma). Nucli format per 38 protons i 67 neutrons. És un isòtop molt inestable, amb una semivida de 0,02 s.
L’àtom neutre de rubidi conté 38 electrons, amb una configuració basal d’escorça de 1s22s22p63s23p63d104s24p65s2. Això el situa com l’element del període 5 del grup 2 (metalls alcalino-terris, bloc s). L’estat d’oxidació més habitual és +2 (Sr2+, corresponent al despreniment dels dos electrons del nivell 5s) i, més ocasionalment, +1 i 0. El radi atòmic és de 2,15•10-10 m, i el radi de Van der Waals de 2,49•10-10 m.

Cristalls sintètics d’estronci 99,95%, envasats en vidre sota una atmosfera d’argó. Per tal de preservar l’estronci elemental, hom també pot submergir-lo en hidrocarburs líquids (oli mineral, querosè)
En condicions estàndards de pressió i de temperatura, l’estronci es presenta com un sòlid metàl•lic, de color gris argentí i força tou (1,5 en l’escala de Mohs). La densitat a 273,16 K i 101325 Pa és de 2640 kg•m-3. S’han descrit tres al•lòtrops, amb punts de transició situats, en condicions estàndards de pressió, a 510 K i 810 K.

Les sals volàtils d’estronci emeten, sota la flama, un color vermell brillant. Aquesta propietat és emprada en pirotècnica
En condicions estàndards de pressió, l’estronci fon a 1050 K. En el punt de fusió, la densitat de l’estronci elemental líquid és de 2375 kg•m-3.
En condicions estàndards de pressió, l’estronci elemental bull a 1650 K.

L’estronci metàl•lic és altament reactiu amb l’aire i l’aigua. En la imatge veiem una peça d’estronci en forma dendrítica submergida en aigua i fortament oxidada. L’estronci metàl•lic amb aigua produeix hidròxid d’estronci i provoca l’alliberament de gas H2. En presència d’aire forma espontàniament SrO i, de fet, si es troba en forma de pols fina, entra en ignició.
La reactivitat de l’estronci fa que el trobem més habitualment en forma de compostos:
– òxid d’estronci (SrO, estròncia).
– nitrur d’estronci (Sr3N2). L’estronci elemental dóna lloc al nitrur en presència d’aire atmosfèric de manera espontània tan sols a temperatures superiors a 653 K.
– sulfat d’estronci (SrSO4). És poc soluble en aigua.
– carbonat d’estronci (SrCO3). De color blanc o gris, és poc soluble en aigua.
L’abundància de l’estronci és condicionada per les taxes de nucleosíntesi, l’estabilitat dels seus isòtops i el fet de trobar-se alguns en les vies de desintegració d’isòtops radioactius d’altres elements. Com correspon als elements de Z parell, l’estronci és més abundant que els dos elements que el flanquegen en la taula periòdica, el rubidi i l’itri. Entre els elements de Z inferior que són atòmicament menys abundants que l’estronci hi ha el beril•li, el bor, l’arsènic i el brom. Dels elements de Z no n’hi ha cap de més abundant que l’estronci.
L’estronci és classificat entre els elements litòfils. Els seus compostos posseeixen propietats intermèdies entre les del calci i del bari, amb especial similitud amb el primer, la qual cosa condiciona la seva distribució planetària, la mineralogènesi i la química en la hidrosfera i biosfera. Globalment, a la Terra l’abundància atòmica de l’estronci és de 3,9 ppm (13 ppm en termes de massa). En l’escorça terrestre, l’abundància màssica de l’estronci és força més elevada, de 360 ppm (la qual cosa el situa com el 15 o 16 element més abundant de la litosfera). Els principals minerals d’estronci són la celestita (SrSO4) i l’estroncianita (SrCO3). La celestita és el mineral més explotable per aconseguí estronci, ja que la trobem més habitualment en grans dipòsits sedimentaris.

La putnisita fou descoberta en el 2007, a la Polar Bear Peninsula (Dundas, Austràlia Occidental) i descrita mineralògiament en el 2012. Químicament consisteix en SrCa4Cr83+(CO3)8(SO4)(OH)16•25 H2O
En la hidrosfera, a pH àcid i neutre, l’estronci es troba en forma de Sr2+, que fàcilment és adsorbit per partícules del sòl per bescanvi catiònic. A pH bàsic, la seva solubilitat disminueix, i és més fàcil la seva coprecipitació amb calci. La concentració oceànica mitjana d’estronci és de 8 mg•L-1 (90 μmol•L-1).
La presència en l’atmosfera és transitòria i en forma de traça.
En molts sistemes biològics, l’estronci apareix com un substitut molt minoritari del calci. Si realitza realment una funció biològica és quelcom discutit. Entre els radiolaris acantaris hi ha espècies que sintetitzen i secreten celestita (sulfat d’estronci), i que tenen un efecte en la relació Sr/Ca d’algunes regions oceàniques (De Dekker, 2004). Fins a cert punt sembla que uns certs nivells d’estronci contribueixen a un funcionament òptim de diverses teixits mineralogènics, com ara el nostre propi endosquelet.
Amb independència de si té o no realment un rol com a factor de creixement dels ossos, l’estronci es troba en el cos humà amb unes concentracions de 4,6 ppm en termes de massa (0,33 ppm en termes atòmics). Així el contingut en un cos de 70 kg, seria de 320 mg. La dosi diària recomanada d’estronci seria de 680 mg diaris. Normalment, els aliments la forneixen a bastament, però també es comercialitzen suplements (citrat, carbonat). Algunes pastes de dents són suplementades fins a un 10% de SrCl2•6 H2O.
El metabolisme humà de l’estronci és paral•lel al del calci en termes d’absorció, deposició i excreció. En termes generals la ratio Sr/Ca en els teixits ossis i en el sèrum és similar (1:1000-1:2000). El tropisme de l’estronci cap a l’os és aprofitat en radiomedicina diagnòstica (gammagrafies amb 85Sr i 87Sr) i terapèutica. Alhora, explica l’alta taxa de permanència en el cos de l’estronci cosa que fa que 90Sr sigui un dels radioisòtops més tòxics en residus nuclears.
El ranelat d’estronci és emprat com a fàrmac promotor del creixement i de la densitat òssia. Comercialitzat per Servier com a Protelos o Protos en el “tractament” de l’osteoporosi, actuaria com un agent ossi doble, promovent la deposició de nou os per osteoblasts i reduint la reabsorció d’os per osteoclasts. Possibles efectes secundaris, probablement lligats a una interferència del metabolisme del calci en altres sistemes (com la musculatura cardíaca), fan que sigui indicat exclusivament a dones postmenopàusiques amb osteoporosi severa i alt risc de fractura.
Ranelat d’estronci
Aplicat tòpicament, diversos compostos d’estronci semblen inhibir la irritació sensorial i accelerar la taxa de recuperació de la funcionalitat de la pell després de lesions.
En recerca biomèdica, l’estronci pot ser utilitzat com a anàleg del calci en l’estudi de diversos processos (alliberament de neurotransmissors, contracció muscular, senyalització intracel•lular).
Aplicacions de l’estronci
La producció anual d’estronci és d’unes 380.000 tones. El principal mineral explotat és la celestita (SrSO4). La major part d’aquest sulfat d’estronci (unes 300.000 tones anuals) és convertit a carbonat, bé mitjançant la lixiviació amb una solució de carbonat sòdic, o torrant-lo amb carbó. En aquest segon cas, en resulta sulfur d’estronci (SrS), amb aspecte de cendra negra, que, una vegada dissolt i filtrat en aigua, en afegir-s’hi diòxid de carboni, precipita carbonat d’estronci. A la producció d’estronci, cal afegir l’estronci procedent del reciclatge.

Espècimen de celestita, de la mina Machow, de Polònia
L’estronci metàl•lic es prepara de l’estròncia (òxid d’estronci), reduint-la amb alumini. També se’l pot preparar per electròlisi de clorur d’estronci, prèvia dilució en clorur potàssic fos. L’estronci és emprat en aliatges d’alumini i magnesi, com ara l’AJ62 (un aliatge de magnesi amb un 2% d’estronci, emprat en motors).

Tub de raigs catòdics. La pantalla fluorescent dels tubs de raigs catòdics tradueix en senyal lluminosa els feixos d’electrons que creuen el tub. L’estronci i el bari són emprats en la part de pantalla del vidre del tub per impedir l’escapament de raigs X, mentre que en la zona del coll i del fúnel s’afegeix plom al vidre. El contingut típic de SrO del vidre del tub de raigs catòdics és del 8,5% (i del 10% de BaO). En el moment àlgid de l’ús dels tubs de raigs catòdics en la televisió en color, el 75% de la producció d’estronci anava encaminada a aquesta finalitat
A mesura que diversos tipus de dispositius desplacen a les pantalles de tubs de raigs catòdics, disminueix el pes quantitatiu que aquesta aplicació tenia en el consum global mundial d’estronci.
En pirotècnia, el carbonat d’estronci i d’altres sals d’estronci són emprades per aconseguir un vermell profund. Quantitativament, suposa el 5% del consum mundial d’estronci, proporció que aniria en creixença.
En la refineria de zinc, l’estronci és emprat en la remoció d’impureses de plom.
Ja hem esmentat amb anterioritat diverses aplicacions mèdiques de l’estronci i dels seus isòtops radioactius. El 89Sr és el principi actiu del Metastron, radiofàrmarc emprat per tractar el dolor en tumors ossis metastàtics.

Generador termoelèctric de radioisòtops Beta-M de fabricació soviètica, utilitzats per alimentar fars i estacions metereològiques en el litoral àrtic. El fluorur d’estronci enriquit en 90Sr, procedent de residus nuclears, arribava a produir fins a 0,93 watts/gram.
A un nivell més o menys experimental, podem citar diverses aplicacions de compostos d’estronci:
– titanat d’estronci (SrTiO3), amb propietats interessants (elevat índex refractiu) per a aplicacions òptiques.
– aluminat d’estronci (SrAl2O4): emprat com a material fosforescent de llarga persistència.
– niobat d’estronci i bari (Sr x B – x Nb2O6): emprat en alguns dispositius hologràfics a l’aire lliure.