Tic, tac, tic, tac. “El segon és la durada de 9192631770 períodes de la radiació corresponent a la transició entre els dos nivells hiperfins de l’estat fonamental de l’àtom de cesi-133 en repòs a una temperatura de 0 K”. Tic, tac, tic, tac. Aquesta definició atòmica (electrònica) del segon, constituït així en la unitat fonamental de temps en el Sistema Internacional, superava finalment les definicions astronòmiques. Tic, tac, tic, tac. Etimològicament, el segon era la “segona divisió sexagesimal de l’hora”, i l’hora mateixa era definida com la divisió duodecimal del dia. Tic, tac, tic, tac. Però els moviments dels astres no són tan perfectes com les transicions de l’electró 6s de l’àtom de cesi-133 en repòs a 0 K. Tic, tac, tic, tac. Escrivim aquest text en l’època d’Unix de 1423387681 [segons], en el Segon Julià 212290147646. Tic, tac, tic, tac. Tenim ja el temps mesurat, despullat de tota contingència que depengui de la grollera rotació de la Terra o de la irregular translació al voltant del Sol. Tic, tac, tic, tac. Però, què él temps? Un instant, l’interval entre dos instants, la durada de l’interval. Tic, tac, tic, tac. El temps atòmic internacional (TAI) encara el mantenim lligat amb la rotació de la Terra, i el coordinem en el Temps “Universal” a través de segons intercalats que produeixen marques de rellotge tan insòlites com “2015-06-30 23:59:60”. Tic, tac, tic, tac. Eddington ens demana que dibuixem una sageta. Tic, tac, tic, tac. Si mentre seguim la sageta trobem més i més aleatorietat en l’estat del món, llavors la sageta assenyala el futur. Tic, tac, tic, tac. Si mentre seguim la sageta l’aleatorietat disminueix, llavors la sageta assenyala el passat. Tic, tac, tic, tac. Eddington ens diu que aquesta és l’única distinció coneguda per la física. Tic, tac, tic, tac. Si admetem, ens diu Eddington, que la introducció d’aleatorietat és l’única cosa que no es pot desfer, llavors haurem de concedir a Eddington l’ús de la frase “la sageta del temps” per expressar aquesta propietat unidireccional del temps, que no té anàleg amb l’espai. Tic, tac, tic, tac. L’espai de Minkowski tracta el temps com la quarta dimensió, addicionada a les tres dimensions espacials. Tic, tac, tic, tac. En el 1908, J. M. E. McTaggart ens deia que el temps no és real perquè les nostres descripcions del temps són bé contradictòries, bé circulars, bé insuficients. Tic, tac, tic, tac. El presentisme, la sèrie A en la terminologia de McTaggart, ens diu que tan sols existeix el present. Tic, tac, tic, tac. L’eternalisme, la sèrie B en la terminologia de McTaggart, afirma la realitat de tot el bloc espai-temporal. Tic, tac, tic, tac. McTaggart també contempla la visió centrada en l’ordre dels fets, la sèrie C. Tic, tac, tic, tac. Podríem afegir la noció d’un bloc espai-temporal creixent, en el qual el passat i present són reals, però el futur no existeix (és obert). Tic, tac, tic, tac. Les teories de la relativitat espacial i general ens mostren l’equivalència de sistemes de coordenades, i somouen la simultaneïtat exigida per la sèrie A. Tic, tac, tic, tac. Però ni la sèrie B ni la sèrie C contemplen el canvi. Tic, tac, tic, tac. I la sageta del temps ha d’ésser explicada en un model fonamental de l’univers. Tic, tac, tic, tac. Sageta o sagetes. Tic, tac, tic, tac. Hi ha la sageta termodinàmica, l’original d’Eddington, però no sabem com connecta amb la sageta cosmològica, amb la sageta radiativa, la sageta causal, la sageta de l’energia nuclear feble, la sageta psicològica. Tic, tac, tic, tac. Nosaltres arribem al nombre 55 de la nostra sèrie.

Tic, tac, tic, tac
Gustav Robert Kirchhoff i la descoberta del cesi

Gustav Robert Kirchhoff
Gustav Robert Kirchhoff nasqué a Königsberg (Regne de Prússia) el 12 de març del 1824, fill del matrimoni format per Johanna Henriette Wittke i l’advocat Friedrich Kirchhoff. Ingressà a la Universitat de Königsberg el 1842, i hi féu estudis de matemàtica i física, amb professors com Franz Ernst Neumann (1798-1895), Friedrich Julius Richelot (1808-1875) o Carl Gustav Jacob Jacobi (1804-1851). En el 1845 publicà un article a Annalen der Physik und Chemie, que posava les bases teòriques del funcionament dels circuits elèctrics (“regles de Kirchhoff”), bo i lligant els fenòmens de descàrrega, corrent i resistència.
Graduat el 1847, es traslladà a Berlín. El 1850 aconseguí una posició docent en la Universitat de Breslau (Silèsia prussiana), que deixà el 1854, per passar a la Universitat de Heidelberg (Gran Ducat de Baden).
Promès de feia anys amb Clara Richelot, la filla de qui fou el seu professor de matemàtica a Königsberg, s’hi va casar en el 1857. Del matrimoni en naixerien dos fills i dues filles.
A Heidelberg, Kirchhoff continuà amb els seus estudis teòrics i pràctics sobre l’electricitat. En el 1857, calculà que els senyals elèctrics, en un fil conductor teòric de resistència nul•la, es transmetien a la velocitat de la llum. En el 1859, formulà una llei de radiació tèrmica, segons la qual:
“Per a un cos de qualsevol material arbitrari, que emet i absorbeix radiació electromagnètica tèrmica a qualsevol longitud d’ona en equilibri termodinàmic, la raó de la seua potència d’emissió amb el seu coeficient adimensional d’absorció és igual a una funció universal de tan sols la longitud d’ona radiativa i la temperatura, la potència d’emissió del cos negre perfecte”.

Robert Bunsen (1811-1899)
En el 1859, Robert Bunsen i Gustav Kirchhoff havien construït al seu laboratori de Heidelberg un espectroscopi. Kirchhoff havia treballat en l’estudi de les línies espectrals de la llum solar, així com de diferents sistemes d’il•luminació artificial. Amb l’espectroscopi, Bunsen i Kirchhoff estudiaren la base química d’aquestes línies espectrals. Mentre Kirchhoff desenvolupava les lleis fonamentals de l’espectroscopia, Bunsen orientava aquesta recerca a l’anàlisi química.

Línies espectrals del cesi. En termes generals, els compostos de cesi emeten sota la flama una coloració blava o violada
En el 1860, en el decurs d’aquest treball de caracterització química de les línies espectrals i, alhora, de caracterització espectral de substàncies químiques, analitzaven aigües minerals de diferents procedències. En una mostra d’aigua procedent de Dürkheim (Palatinat bavarès), observaren unes línies en la zona del blau que no eren atribuïbles a cap dels elements coneguts. Postularen que es podia tractar d’un element desconegut (Kirchhoff & Bunsen, 1861). Proposaren el nom de cesi (caesium), pel fet que les línies eren en la banda del blau celeste i, com recordava Bunsen, un passatge de les “Noctes Atticae” testimoniava aquest mot: “Nostris autem ueteribus caesia dicts ets quae Graecis, ut Nigidus ait, de colore coeli qausi coelia”.

Esquema d’un dels espectroscopi de Kirchhoff. Es carrega la mostra (E) que és col•locada sota la flama que forneix un encenedor de gas (D, encenedor Bunsen). Aquesta llum és conduïda (B) a un prisma (F) que la descompon. A través d’un altre visor (C) s’observa l’espectre resultant. Les línies espectrals es deuen a les substàncies aportades a la flama per la mostra.
Si es confirmava la descoberta, es tractaria del primer element químic descobert per anàlisi espectroscòpica. La confirmació, però, requeria aïllar l’element o un compost seu. Bunsen i Kirchhoff arribaren a processar un total de 44.000 litres d’aigua de Dürkheim. Evaporades, això dóna un total de 240 quilograms de solució salina concentrada. Realitzaren diferents fraccionaments, precipitacions, conversions amb àcid nítric, extraccions amb etanol, etc. Sospitaven que es tractava d’un metall alcalí o alcalino-terri, i en aquest sentit calia precipitar-los, però alhora separant-hi el sodi i el liti. Van emprar àcid cloroplatínic sobre la solució processada, obtenint hexacloroplatinats, insolubles a aigua freda però solubles a aigua escalfada. En resum, del procés van aconseguir uns 7,3 grams de clorur de cesi.
Van estudiar aquesta sal. A través del seu pes molecular, estimaren el pes atòmic del cesi en 123,35 equivalents d’hidrogen. Intentaren d’aïllar el cesi, sotmetent el clorur de cesi fos a electròlisi. Obtingueren una substància homogènia blava “que ni a ull nu ni sota el microscopi mostrava la més mínima traça de substància metàl•lica”. Conclogueren que l’electròlisi havia transformat el clorur de cesi en un subclorur, però no pas en el cesi metàl•lic que esperaven. També intentaren fer l’electròlisi del clorur de cesi amalgamat amb mercuri, però l’amalgama era inestable en solució aquosa.
Encara que Kirchhoff i Bunsen no foren capaços d’obtindre en estat elemental ni el cesi ni el rubidi, els dos elements que havien descobert amb les seves anàlisis espectroscòpiques, tots dos elements foren aviat acceptats. Com a símbol químic del cesi s’empra Cs. Les diferents llengües utilitzen el nom llatí, ja en la forma més acceptada, caesium o en la més relaxada de cesium, amb les adaptacions fonètiques i gràfiques que correspongui.
D’aquesta manera quan, en el 1865, John Newlands fa una proposa de sistematització dels elements químics, inclou el cesi (Cs) assignant-li un nombre elemental de 44, la qual cosa el posava en el grup del liti (juntament amb el sodi, el potassi, el coure, el rubidi, l’argent i l’osmi). De fet, les propietats químiques adscrivien el rubidi i el cesi al grup de metalls alcalins definits per la tríada del liti, sodi i potassi.
En la taula periòdica de Mendeleev del 1869, el grup dels metalls alcalins és clarament distingit. El cesi, amb un pes atòmic més ben estimat de 133, és inclòs en aquest grup, dins del cinquè període.
En la taula del 1871, Mendeleev compacta els grups, de manera que fa entrar en aquest grup de metalls alcalins, també l’hidrogen, el coure, l’argent i l’or. Això fa passar el cesi al període 8. No obstant, Mendeleev posa entre parèntesi l’adscripció dels metalls nobles a aquest grup. Formulacions posteriors els separaren, i deixaran aquest grup 1 integrat exclusivament per l’hidrogen i els metalls alcalins, amb el cesi situat en el període 6.
Kirchhoff, mentrestant, havia enviudat (1869). El 1872, es casà amb Luise Brömmel, la qual fins llavors havia treballat en la Clínica Oftalmològica de Heidelberg. El 1875, Kirchhoff esdevingué professor de la nova càtedra de física teòrica inaugurada a la Universitat de Berlín. Les seves nombroses i fonamentals aportacions en diferents camps de la física (electricitat, òptica, mecànica de plaques, termodinàmica) foren reconegudes amb múltiples premis (la medalla Rumford, el 1862; o les medalles Davy i Matteucci, concedides en 1877; o la medalla Janssen, de 1887). El 1886, per raons de salut, abandonà la seva posició a la Universitat de Berlín, i es morí a aquesta ciutat el 17 d’octubre del 1887.
En el 1882, Carl Setterberg, en el decurs de la seva tesi doctoral, feta sota la direcció d’August Kekulé (1829-1896) i Robert Bunsen, treballà en l’aïllament del cesi metàl•lic. Ho aconseguí a través de l’obtenció de cianur de cesi i posterior electròlisi.
Els usos del cesi han estat, en termes generals, limitats, concentrats en l’àmbit de la recerca. Inicialment fou utilitzat en recerca química i elèctrica. A partir dels anys 1920 fou utilitzat en un tubs de buit, d’una banda com a agent per eliminar l’excés d’oxigen durant la fabricació, de l’altra com a revestiment del càtode, que alhora n’augmenta la conductivitat elèctrica. A partir dels anys 1950, la metal•lúrgia comença a fer-ne ús en aliatges especialitzats.
En el desenvolupament de rellotges atòmics, Louis Essen i William Markowitz treballaren especialment amb cesi. El caràcter monoisotòpic de l’element (cesi-133) i el fet de disposar d’un únic electró en l’última capa de l’escorça electrònica, feia atractiva la utilització de la transició hiperfina d’aquest electró 6s. Essen i Markowitz mesuraren amb força precisió la freqüència de la transició en l’estat basal de l’àtom de cesi-133. Capgiraren aquesta mesura per determinar que un segon equivalia a 91925631770±20 cicles d’aquesta freqüència. Empraven la definició del “segon” que havia adoptat la 11ª Conferència General de Pesos i Mesures:
“El segon és la fracció 1/31556925,9747 de l’any tròpic corresponent al 0 de gener del 1900 a les 12 hores del temps d’efemèrides”.
Aquesta curiosa definició havia substituït l’anterior (la que definia el segon com la 1/84600 part del “dia solar mitjà”). Ara es tractava de fer un pas més, i proposar una equivalència exacta del segon amb els 91925631770 cicles de la transició hiperfina del nivell 6s de l’àtom de cesi-133. Efectivament, aquesta definició seria adoptada en la 13ª Conferència (1967). En el 1971 hom tingué present l’efecte de la temperatura en la freqüència, de manera que es definiren unes condicions de “zero absolut” (0 K).

Rellotge atòmic del 1976, amb la seva bateria a sota
El desplegament de l’òptica augmentà en les dècades següents les aplicacions del cesi en cèl•lules fotoelèctriques, fotomultiplicadors, espectrofotòmetres d’infraroig, cristalls de comptadors d’escintil•lació, etc.
L’accident nuclear del Reactor 4 de Txernòbil, el 26 d’abril del 1986, tingué com a principals amenaces les emissions de cesi-137 i cesi-134, al costat de les emissions de iode-131 i estronci-90. Constitueix encara avui la principal font radioactiva en la zona d’exclusió.
Evolució de la contribució de diferents fonts a la radiació resultant de l’accident nuclear de Txernòbil. En passar els mesos, el cesi-137 esdevingué l’única radiofont de consideració.
El 13 de setembre del 1987, Roberto dos Santos Alves i Wagner Mota Pereira entraren en instal•lacions abandonades de l’Instituto Goiano de Radioterapia (Goiânia, Brasil) i se’n dugueren diversos dispositius. No sabien que un d’ells era una unitat de teleteràpia. En manipular-la s’exposaren a radiocesi. En desmuntar el dispositiu i vendre’n les peces, l’exposició augmentà. En resultà un brot epidèmic que, el 29 de setembre, el metge Walter Mendes Ferreira identificà com una exposició radiològica. En total, els hospitals registraren 250 persones efectivament exposades, amb un total de quatre morts.
El maig del 1998, fou un altre cas de contaminació radioactiva per cesi-137. L’origen en aquest cas fou la planta de reciclatge metàl•lic d’Acerinox de Los Barrios (Cádiz). Peces procedents d’un generador de raigs gamma foren processades. Ni en les peces ni en els fums de la planta se’n detectà radioactivitat, però sí que la registraren detectors atmosfèrics (fins i tot a l’Europa central). Fins que no es detectà l’origen, s’arribà a nivells radioactius en les cendres de la planta 640-1420 Bq/g. Un total de sis persones patiren exposicions moderades.
L’accident nuclear de Fukushima, de l’abril del 2011, provocà emissions de cesi-137. Hom ha seguit els nivells de radioactivitat induïts en la cadena alimentària. En juliol del 2011, se’n detectaren nivells de cesi-137 de 1530-3200 Bq/kg en carn bovina de la prefectura de Fukushima (3-6 vegades superior als límits legals). En març del 2013, se’n detectà en una mostra de peix propera a la central nivells de 740000 Bq/kg (7400 vegades superiors al límit legal). Això fa del cesi-137 la principal preocupació sanitària en els treballs de descontaminació.
El cesi: isòtops i abundància
La massa atòmica estàndard del cesi és de 132,90545196 uma, coincident amb la del seu únic isòtop (observacionalment) estable, el 133Cs. Un llistat complet dels isòtops coneguts faria:
– cesi-112 (112Cs; 111,95030 uma). Nucli format per 55 protons i 57 neutrons. És un isòtop molt inestable, amb una semivida de 5•10-4 s. Decau bé a xenó-111 (amb emissió d’un protó) bé a iode-108 (amb emissió d’un nucli d’heli-4).
– cesi-113 (113Cs; 112,94449 uma). Nucli format per 55 protons i 58 neutrons. És un isòtop molt inestable, amb una semivida de 1,67•10-5 s. Decau normalment (99,97%) a xenó-112 (amb emissió d’un protó) o, alternativament (0,03%), a xenó-113 (amb emissió d’un positró).
– cesi-114 (114Cs; 113,94145 uma). Nucli format per 55 protons i 59 neutrons. És un isòtop molt inestable, amb una semivida de 0,57 s. Decau majoritàriament (91,09%) a xenó-114 (amb emissió d’un positró) o, alternativament, a iode-113 (8,69%; amb emissió d’un protó i d’un positró), a tel•luri-110 (0,19%; amb emissió d’un nucli d’heli-4 i d’un positró) o a iode-110 (0,018%; amb emissió d’un nucli d’heli-4).
– cesi-115 (115Cs; 114,93591 uma). Nucli format per 55 protons i 60 neutrons. És un isòtop inestable, amb una semivida de 1,4 s. Decau normalment (99,93%) a xenó-115 (amb emissió d’un positró) o, alternativament (0,07%), a iode-114 (amb emissió d’un protó i d’un positró).
– cesi-116 (116Cs; 115,93337 uma). Nucli format per 55 protons i 61 neutrons. És un isòtop molt inestable, amb una semivida de 0,70 s. Decau normalment (99,67%) a xenó-116 (amb emissió d’un positró) o, alternativament, a iode-115 (0,279%; amb emissió d’un protó i d’un positró) o a tel•luri-112 (0,049%; amb emissió d’un nucli d’heli-4 i d’un positró). Posseeix un estat metastable (116mCs) a 100 keV, que té una semivida de 3,85 s, i que decau bé a xenó-116 (99,48%), a iode-115 (0,51%) o a tel•luri-112 (0,008%).
– cesi-117 (117Cs; 116,92867 uma). Nucli format per 55 protons i 62 neutrons. És un isòtop inestable, amb una semivida de 8,4 s. Decau a xenó-117 amb emissió d’un positró. Posseeix un estat metastable (117mCs) a 150 keV, que té una semivida de 6,5 s, i que decau a xenó-117.
– cesi-118 (118Cs; 117,926559 uma). Nucli format per 55 protons i 63 neutrons. És un isòtop inestable, amb una semivida de 14 s. Decau normalment (99,95%) a xenó-118 (amb emissió d’un positró) o, alternativament, a iode-117 (0,042%; amb emissió d’un protó i d’un positró) o a tel•luri-114 (0,0024%; amb emissió d’un nucli d’heli-4 i d’un positró). Posseeix un estat metastable (118mCs) a 100 keV, que té una semivida de 17 s, i que decau bé a xenó-118 (99,95%), iode-117 (0,042%) o a tel•luri-114 (0,0024%).
– cesi-119 (119Cs; 118,922377 uma). Nucli format per 55 protons i 64 neutrons. És un isòtop inestable, amb una semivida de 43,0 s. Decau normalment a xenó-119 (amb emissió d’un positró) o, alternativament (0,000002%), a tel•luri-115 (amb emissió d’un nucli d’heli-4 i d’un positró). Posseeix un estat metastable (119mCs) a 50 keV, que té una semivida de 30,4 s i que decau a xenó-119.
– cesi-120 (120Cs; 119,920677 uma). Nucli format per 55 protons i 65 neutrons. És un isòtop inestable, amb una semivida de 61,2 s. Decau normalment a xenó-120 (amb emissió d’un positró) o, alternativament, a tel•luri-116 (0,00002%; amb emissió d’un nucli d’heli-4 i d’un positró) o a iode-118 (0,000007%; amb emissió d’un protó i d’un positró). Posseeix un estat metastable (120mCs) a 100 keV, que té una semivida de 57 s, i que decau normalment a xenó-120 o, alternativament, a tel•luri-116 (0,00002%) o a iode-118 (0,000007%).
– cesi-121 (121Cs; 120,917229 uma). Nucli format per 55 protons i 66 neutrons. És un isòtop inestable, amb una semivida de 155 s. Decau a xenó-121, amb emissió d’un positró. Posseeix un estat metastable (121mCs) a 68,5 keV, que té una semivida de 122 s, i que decau bé a l’estat basal (17%) o directament a xenó-121 (83%).
– cesi-122 (122Cs; 121,91611 uma). Nucli format per 55 protons i 67 neutrons. És un isòtop inestable, amb una semivida de 21,18 s. Decau normalment a xenó-122 (amb emissió d’un positró) o, alternativament (0,0000002%), a tel•luri-118 (amb emissió d’un nucli d’heli-4 i d’un positró). Posseeix tres estats metastables, un a 45,8 keV (122m1Cs; que té una semivida de poc més de 10-6 s), un altre a 140 keV (122m2Cs; que té una semivida de 222 s i que decau a xenó-122) i un tercer a 127,05 keV (122m3Cs; que té una semivida de 0,36 s).
– cesi-123 (123Cs; 122,912996 uma). Nucli format per 55 protons i 68 neutrons. És un isòtop inestable, amb una semivida de 353 s (6 minuts). Decau a xenó-123, amb emissió d’un positró. Posseeix dos estats metastable, un a 156,27 keV (123m1Cs; que té una semivida de 1,64 s, i que decau a l’estat basal) i un altre a 231,63 keV (123m2Cs; que té una semivida de 1,14•10-7 s).
– cesi-124 (124Cs; 123,912258 uma). Nucli format per 55 protons i 69 neutrons. És un isòtop inestable, amb una semivida de 30,9 s. Decau a xenó-124, amb emissió d’un positró. Posseeix un estat metastable (124mCs) a 462,55 keV, que té una semivida de 6,3 s i que decau a l’estat basal.
– cesi-125 (125Cs; 124,909728 uma). Nucli format per 55 protons i 70 neutrons. És un isòtop inestable, amb una semivida de 2800 s (47 minuts). Decau a xenó-125, amb emissió d’un positró. Posseeix un estat metastable (125mCs) a 266,6 keV, que té una semivida de 0,9 s.
– cesi-126 (126Cs; 125,909452 uma). Nucli format per 55 protons i 71 neutrons. És un isòtop inestable, amb una semivida de 98,4 s. Decau a xenó-126, amb emissió d’un positró. Posseeix dos estats metastable, un a 273,0 keV (126m1Cs, que té una semivida de poc més de 10-6 s) i un altre a 596,1 keV (126m2Cs, que té una semivida de 1,71•10-4 s).
– cesi-127 (127Cs; 126,907418 uma). Nucli format per 55 protons i 72 neutrons. És un isòtop inestable, amb una semivida de 2,25•104 s (6 hores). Decau a xenó-127, amb emissió d’un positró. Posseeix un estat metastable (127mCs) a 452,23 keV, que té una semivida de 5,5•10-5 s.
– cesi-128 (128Cs; 127,907749 uma). Nucli format per 55 protons i 73 neutrons. És un isòtop inestable, amb una semivida de 218,4 s. Decau a xenó-128, amb emissió d’un positró.
– cesi-129 (129Cs; 128,906709 uma). Nucli format per 55 protons i 74 neutrons. És un isòtop inestable, amb una semivida de 1,154•105 s (32 hores). Decau a xenó-129, amb emissió d’un positró.
– cesi-130 (130Cs; 129,906709 uma). Nucli format per 55 protons i 75 neutrons. És un isòtop inestable, amb una semivida de 1753 s (29 minuts). Decau majoritàriament (98,4%) a xenó-130 (amb emissió d’un positró) o, alternativament (1,6%), a bari-130 (amb emissió d’un electró). Posseeix un estat metastable (130mCs) a 163,25 keV, que té una semivida de 208 s i que decau bé a l’estat basal (99,83%) bé directament a xenó-130 (0,16%).
– cesi-131 (131Cs; 130,905464 uma). Nucli format per 55 protons i 76 neutrons. És un isòtop inestable, amb una semivida de 8,371•105 s (10 dies). Decau a xenó-131, per captura electrònica.
– cesi-132 (132Cs; 131,9064343 uma). Nucli format per 55 protons i 77 neutrons. És un isòtop inestable, amb una semivida de 5,599•105 s (6 dies). Decau majoritàriament (98,13%) a xenó-132 (amb emissió d’un positró) o, alternativament (1,87%), a bari-132 (amb emissió d’un electró).
– cesi-133 (133Cs; 132,905451933 uma). Nucli format per 55 protons i 78 neutrons. És un isòtop estable, per bé que teòricament susceptible de fissió espontània. És pràcticament l’únic isòtop present en mostres naturals (100,00%). Part de la dotació resulta de la fissió de radioisòtops pesants.
– cesi-134 (134Cs; 133,906718475 uma). Nucli format per 55 protons i 79 neutrons. És un isòtop inestable, amb una semivida de 6,5173•107 s (2 anys). Decau normalment a bari-134 (amb emissió d’un electró) o, alternativament (0,0003%), a xenó-134 (per captura electrònica). És producte de la fissió de radioisòtops més pesants. En centrals nuclears és generat directament per fissió o, sobretot, a través de la captura neutrònica del cesi-133. El cesi-134 posseeix un estat metastable (134mCs) a 138,7441 keV, que té una semivida de 1,048•104 s i que decau a l’estat basal.
– cesi-135 (135Cs; 134,9059770 uma). Nucli format per 55 protons i 80 neutrons. És un isòtop inestable, amb una semivida de 7,3•1013 s (2,3 milions d’anys). Decau a bari-135, amb emissió d’un electró. És producte de la fissió de radioisòtops pesants. És comptat entre els productes radioactius de la fissió nuclear de llarga semivida, dels quals és l’únic metall alcalí. El cesi-135 posseeix un estat metastable (135mCs) a 1632,9 keV, que té una semivida de 3200 s i que decau a l’estat basal.
– cesi-136 (136Cs; 135,9073116 uma). Nucli format per 55 protons i 81 neutrons. És un isòtop inestable, amb una semivida de 1,137•106 s (13 dies). Decau a bari-136, amb emissió d’un electró. En centrals nuclears, és producte directe de la fissió nuclear i, indirectament, per la captura neutrònica de cesi-135. Posseeix un estat metastable (136mCs) a 518 keV, que té una semivida de 19 s, i que decau bé a l’estat basal bé directament a bari-136.
– cesi-137 (137Cs; 136,9070895 uma). Nucli format per 55 protons i 82 neutrons. És un isòtop inestable, amb una semivida de 9,52001•108 s (30 anys). Decau, amb emissió d’un electró, majoritàriament a 137mBa (95%) o, alternativament, al bari-137 basal (5%). És producte de la fissió de radioisòtops més pesants. Constitueix, juntament amb l’estronci-90, en la principal font radioactiva de residus de centrals nuclears (des d’anys fins a segles després del refredament). En aquest sentit, fou alliberat a l’ambient en els assaigs d’armes nuclears i en accidents de centrals. En l’accident de Txernòbil fou un dels contaminants radioactius més rellevants (amb una deposició de 1 mg/kg en regions tan allunyades com Alemanya) i vint anys després encara constituïa la principal font de radiació en l’anomenada “zona d’exclusió”. El cesi-137, conegut habitualment com a radiocesi, té diverses aplicacions: calibració de detectors de radioactivitat, com a traçador hidrològic i en datació de sediments i de productes (en el benentès que era una substància pràcticament inexistent abans de juliol del 1945). Se l’ha utilitzat també en tractament oncològic.
– cesi-138 (138Cs; 137,911017 uma). Nucli format per 55 protons i 83 neutrons. És un isòtop inestable, amb una semivida de 2004 s (33 minuts). Decau a bari-138, amb emissió d’un electró. Posseeix un estat metastable (138mCs) a 79,9 keV, que té una semivida de 175 s (3 minuts) i que decau bé a l’estat basal (81%) bé directament a bari-138 (19%).
– cesi-139 (139Cs; 138,913364 uma). Nucli format per 55 protons i 84 neutrons. És un isòtop inestable, amb una semivida de 556 s (9 minuts). Decau a bari-139, amb emissió d’un electró.
– cesi-140 (140Cs; 139,917282 uma). Nucli format per 55 protons i 85 neutrons. És un isòtop inestable, amb una semivida de 63,7 s. Decau a bari-140, amb emissió d’un electró.
– cesi-141 (141Cs; 140,920046 uma). Nucli format per 55 protons i 86 neutrons. És un isòtop inestable, amb una semivida de 24,84 s. Decau normalment (99,96%) a bari-141 (amb emissió d’un electró) o, alternativament (0,0349%), a bari-140 (amb emissió d’un neutró i d’un electró).
– cesi-142 (142Cs; 141,924299 uma). Nucli format per 55 protons i 87 neutrons. És un isòtop inestable, amb una semivida de 1,689 s. Decau normalment (99,9%) a bari-142 (amb emissió d’un electró) o, alternativament (0,091%), a bari-141 (amb emissió d’un neutró i d’un electró).
– cesi-143 (143Cs; 142,927352 uma). Nucli format per 55 protons i 88 neutrons. És un isòtop inestable, amb una semivida de 1,791 s. Decau majoritàriament (98,38%) a bari-143 (amb emissió d’un electró) o, alternativament (1,62%), a bari-142 (amb emissió d’un neutró i d’un electró).
– cesi-144 (144Cs; 143,932077 uma). Nucli format per 55 protons i 89 neutrons. És un isòtop molt inestable, amb una semivida de 0,994 s. Decau majoritàriament (96,8%) a bari-144 (amb emissió d’un electró) o, alternativament (3,2%), a bari-143 (amb emissió d’un neutró i d’un electró). Posseeix un estat metastable (144mCs) a 300 keV, que té una semivida de menys d’1 s, i que decau bé a l’estat basal bé directament a bari-144.
– cesi-145 (145Cs; 144,935526 uma). Nucli format per 55 protons i 90 neutrons. És un isòtop molt inestable, amb una semivida de 0,582 s. Decau majoritàriament (85,7%) a bari-145 (amb emissió d’un electró) o, alternativament (14,3%), a bari-144 (amb emissió d’un neutró i d’un electró).
– cesi-146 (146Cs; 145,94029 uma). Nucli format per 55 protons i 91 neutrons. És un isòtop molt inestable, amb una semivida de 0,321 s. Decau majoritàriament (85,8%) a bari-146 (amb emissió d’un electró) o, alternativament (14,2%), a bari-145 (amb emissió d’un neutró i d’un electró).
– cesi-147 (147Cs; 146,94416 uma). Nucli format per 55 protons i 92 neutrons. És un isòtop molt inestable, amb una semivida de 0,235 s. Decau majoritàriament (71,5%) a bari-147 (amb emissió d’un electró) o, alternativament (28,49%), a bari-146 (amb emissió d’un neutró i d’un electró).
– cesi-148 (148Cs; 147,94922 uma). Nucli format per 55 protons i 93 neutrons. És un isòtop molt inestable, amb una semivida de 0,146 s. Decau majoritàriament (74,9%) a bari-148 (amb emissió d’un electró) o, alternativament (25,1%), a bari-147 (amb emissió d’un neutró i d’un electró).
– cesi-149 (149Cs; 148,95293 uma). Nucli format per 55 protons i 94 neutrons. És un isòtop molt inestable, amb una semivida de 0,15 s. Decau bé a bari-149 (amb emissió d’un electró) bé a bari-148 (amb emissió d’un neutró i d’un electró).
– cesi-150 (150Cs; 149,95817 uma). Nucli format per 55 protons i 95 neutrons. És un isòtop molt inestable, amb una semivida de 0,1 s. Decau bé a bari-150 (amb emissió d’un electró) bé a bari-149 (amb emissió d’un neutró i d’un electró).
– cesi-151 (151Cs; 150,96219 uma). Nucli format per 55 protons i 96 neutrons. És un isòtop molt inestable, amb una semivida de 0,06 s. Decau bé a bari-151 (amb emissió d’un electró) bé a bari-150 (amb emissió d’un neutró i d’un electró).

Els metalls alcalins són, dins del seu període, els elements de major radi atòmic empíric. Aquest valor, a més, creix a cada període. Dels elements dels quals s’ha pogut mesurar, el valor més elevat és el del cesi, l’únic que depassa els 250 pm
L’àtom neutre de cesi conté 55 electrons, amb una configuració basal d’escorça de 1s22s22p63s23p63d104s24p64d105s25p66s1. És, doncs, el primer element del sisè període i, com a tal, és integrat en el grup 1 (el grup de l’hidrogen o del liti, els dits “metalls alcalins”). L’estat d’oxidació és gairebé sempre +1. Tan sols rarament el trobem en 0 (cesi metàl•lic) o -1 (anió Cs–). El radi atòmic empíric és de 2,65•10-10 m i el radi de Van der Waals de 3,43•10-10 m.
Cristalls de cesi elemental d’alta puresa envasats en atmosfera d’argó. El cesi és un dels pocs elements que en temperatures ambientals el podem trobar en estat líquid, per bé que solidifica per sota de 300 K. Entre els metalls elementals, tan sols el mercuri té un punt de fusió tan baix. L’aliatge metàl•lic de temperatura de fusió més baixa, de 195 K, és el format per cesi (41%), potassi (47%) i sodi (12%).
En condicions estàndards de pressió i temperatura, el cesi elemental es presenta com un sòlid metàl•lic d’aspecte argentí i coloració daurada. És molt dúctil, amb una densitat en condicions estàndards de 1930 kg•m-3. De tots les substàncies elementals, és el mes tou (0,2 en l’escala de Mohs). Cristal•litza en una xarxa cúbica centrada en el cos.
En condicions estàndards de pressió, el cesi elemental fon a 301,7 K. En el punt de fusió la densitat és de 1843 kg•m-3.
En condicions estàndards de pressió, el cesi elemental bull a 944 K.
En presència d’oxigen, fins i tot en quantitats mínimes, el sòlid metàl•lic s’enfosqueix. El cesi elemental és altament reactiu i fa ignició espontània en presència d’aire. Dels metalls alcalins és el que reacciona més violentament amb l’aigua, fins i tot a temperatures glacials (157 K). Per tot plegat, el cesi metàl•lic és considerat un material perillós, que se sol emmagatzemar o manipular immers en oli mineral o sota atmosfera d’argó.
El cesi pot formar aliatges amb altres metalls alcalins (excepte el liti) i amb l’or (Cs+Au–) i platí (Cs2Pt), així com amalgames amb mercuri (CsHg2, de color negre i llustre metàl•lic; i CsHg, de color daurat). Tan sols fa aliatges amb cobalt, ferro, molibdè, níquel, platí, tàntal o tungstè a temperatures superiors a 950 K. Forma compostos intermetàl•lics fotosensibles amb antimoni, gal•li, indi i tori.
El cesi és l’element químic estable més electropositiu. Es presenta, doncs, habitualment en forma de catió Cs+ i dels seus compostos:
– òxids. En contacte amb l’aire, el cesi metàl•lic dóna lloc principalment a CsO2 per combustió completa. En l’oxidació gradual, és més habital el Cs2O (sòlid cristal•lí de color groc-taronja). També s’han descrit altres òxids, de coloracions diferents, com el CsO3, el Cs7O, Cs4O, Cs11O3, Cs3O (de color verd), CsO, Cs3O2 o Cs7O.
– hidròxid de cesi (CsOH). En condicions estàndards és un sòlid alcalí higroscòpic. És la base més forta en la definició d’Arrhenius.
– halurs: CsF (sòlid blanc higroscòpic, que combina els dos elements naturals més extrems en l’escala de l’electronegativitat), CsCl (sòlid cristal•lí d’estructura cúbica), CsBr (sòlid blanc), CsI (sòlid cristal•lí blanc).
– sulfurs, seleniürs, tel•luriürs.
L’abundància del cesi en l’univers és condicionada pels processos de nucleosíntesi estel•lar. Fonamentalment, se’n produeix en les supernoves, en els processos de captura ràpida de neutrons. Però també hi ha una generació en estels de fusió per processos de captura lenta de neutrons. A més, el cesi és producte de la fissió de radioisòtops d’elements pesants. Com s’esdevé habitualment amb els element de nombre Z senar, tan sols uns pocs isòtops tenen una semivida considerable, i únicament el cesi-133 és observacionalment estable. Això juga en contra de l’abundància atòmica del cesi que és superada per la dels dos elements que el flanquegen en la taula periòdica, el xenó i el bari. Dels elements més lleugers, el cesi supera en abundor el cesi, el niobi, el tecneci, el rodi, l’argent, l’indi i l’antimoni. Dels elements més pesants, el cesi és superat, a banda del bari, pel lantà, el ceri, el neodimi, l’osmi, l’iridi, el platí, el mercuri i el plom.
En el planeta Terra, l’abundància del cesi és de 0,04 ppm en termes de massa (0,007 ppm en termes atòmics). Com a element litòfil, assoleix una abundància força més considerable en la litosfera, on arriba a 3 ppm. És classificat entre els elements litòfils d’elevat radi iònic (“elements incompatibles”), fet que explica la seva distribució en l’escorça. En efecte, en la cristal•lització magmàtica, el cesi es concentra en la fase líquida o de cristal•lització tardana. Els dipòsits de cesi de major concentració corresponen a cossos minerals de pegmatites, on el trobem en la pol•lucita (Cs(AlSi2O6), la lepidolita o la petalita. A diferència dels altres metalls alcalins, no és abundant en roques evaporítiques (assoleix unes 20 ppm en silvita o en carnal•lita). Entre els minerals que contenen quantitats notables de cesi podem esmentar el beril, l’avogadrita ((K,Cs)BF4), la pezzottaïta (Cs(Be2Li)Al2Si6O18), la londonita ((Cs,K)Al4Be4(B,Be)12O28) o la rodizita.

Pol•lucita
La solubilitat de l’ió Cs+ fa que s’hagin de considerar els bescanvis deguts a la solubilització i l’evaporació entre litosfera i hidrosfera. En l’oceà, la concentració típica és de 0,3 mg•m-3.
La presència de cesi en l’atmosfera és en forma de traça transitòria.
El cesi no és comptat entre els bioelements. El trobem en la biosfera de manera passiva. La concentració típica en el cos humà és de 0,021 ppm en termes de massa (0,001 ppm en termes atòmics), de manera que la quantitat total per a una massa corporal de 70 kg, seria de 6 mg.
És la reactivitat la que fa del cesi metàl•lic un “material de risc”. Pel que fa als compostos de cesi, bona part de la toxicitat s’explicaria per la similitud química de l’ió Cs+ amb el K+ (i, en menor, mesura amb el Na+). Això condiciona l’absorció, distribució i excreció del Cs+ així com els aspectes toxodinàmics (hiperirritabilitat, espasmes, etc.).
El cesi no és un contaminant habitual, però si cal tindre present els efectes del cesi radioactiu, tant del cesi-134 com, sobretot, del cesi-137. En humans, el radiocesi absorbit té una vida mitjana biològica de 50-150 dies (que pot reduir-se amb l’administració d’agents quelants com el blau de Prússia). És major la tendència de bioacumulació en plantes, on el cesi-137 segueix distribucions similars al potassi. En casos de contaminació radioactiva, a banda de l’exposició directa cal tindre present l’acumulació en sòls, llacs i flora (particularment, fongs).
Les aplicacions del cesi
La pol•lucita és la principal font mineral de cesi. La mina de major producció de cesi és la mina Tanco, mina subterrània situada a la vora del llac Bernic, de la qual s’estimen unes reserves de 350 mil tones (més de la meitat de les reseves mundials). Entre d’altres mines escampades pel món, podem citar el dipòsit de Bikita (Zimbabwe) o els del desert de Karibib (Namíbia). Com que la producció minera actual de cesi és de 5-10 tones anuals, no hi ha risc d’esgotament a curt o mig termini.
En el processament, la pol•lucita és esmicolada i, alternativament:
– digerida amb àcids forts (HCl, H2SO4, HBr o HF). Segons l’àcid, se n’obtindran clorur, sulfat, bromur o fluoror de cesi.
– descomposta alcalinament (amb carbonat càlcic i clorur càlcic), se n’obté una solució de CsCl
– reduïda directament a cesi metàl•lic. Se’l comercialitza fonamentalment com a cesi 99,8%. Per a grans quantitats s’empren contenidors d’acer inoxidable segellats hermèticament. Per a quantitats de menys de 100 grams, se l’envasa en ampolles de vidre de borosilicat, al buit, sota atmosfera d’argó o submergit en oli mineral.
La major part de la producció de cesi s’orienta a l’obtenció de format de cesi (HCOO–Cs+). Les solucions de format de cesi s’utilitzen en líquids de perforació per a l’extracció de petroli. Aquesta aplicació es desenvolupà a mitjan dels anys 1990, i treu profit de l’alta densitat d’aquesta solució (fins 2300 kg•m-3), la menor toxicitat i la possibilitat de reciclatge.
L’estàndard de cesi és el més utilitzat en rellotges atòmics. Actualment, hi ha rellotges atòmics de cesi que arriben a precisions de 1015 (que és com dir fallar d’1 segon en un període de 30 milions d’anys). El “temps atòmic internacional” és una escala temporal basada en més de 400 rellotges atòmics d’una cinquantena llarga de laboratoris, intercomunicats entre ells i dels quals deriva una circular mensual. Els rellotges atòmics també participen en la temporització dels sistemes de comunicació. Per a les aplicacions a curt termini, hom utilitza de manera creixent l’estàndard de rubidi.
Entre les aplicacions elèctriques i electròniques del cesi esmentarem:
– generadors termoiònics de vapor de cesi.
– magnetòmetres de vapor de cesi.
– cèl•lules fotoelèctriques, on hom treu profit de les propietats fotoemissives de compostos de cesi, com K2CsSb.
– comptadors d’escintil•lació basats en cristalls de CsI, CsBr o CsF, que, com a detectors de raigs X i gamma, s’utilitzen en exploració de minerals, en instal•lacions de recerca en física de partícules.
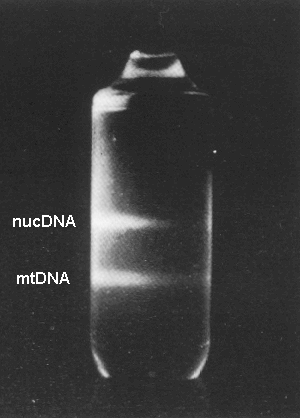
En el 1987, S. M. Carr i O. M. Griffith publicaren a Biochemical Genetics un protocol de “ràpid aïllament d’ADN mitocondrial animal”. Veiem com els quedava el tub de gradient de densitat de CsCl, completada la ultracentrifugació. Sota la llum ultraviolada s’evidencien les bandes d’ADN tenyides prèviament amb bromur d’etidi. L’ADN mitocondrial, conformat per molècules circulars més lleugeres, té major mobilitat i el trobem en la banda inferior. L’ADN nuclear, conformat per molècules més grans, queda en una banda superior.
Alguns experiments clàssics de la història de la biologia molecular, com el de Messelson & Stahl (1958) van utilitzar la ultracentrifugació en gradients de clorur de cesi per a separar finament per pes molecular els seus analits. A banda del CsCl, també s’empren gradients de Cs2SO4 o de Cs(O2CCF3). Entre les aplicacions més destacades actuals, hi ha l’aïllament de partícules víriques o la separació de fraccions subcel•lulars.
Entre d’altres usos de compostos de cesi podem citar:
– el nitrat de cesi, emprat en bengales d’infraroig, com a oxidant i colorant pirotècnic.
– l’ús de fluorur de cesi o de fluorur d’alimini i cesi en les soldadures d’aliatges d’alumini-magnesi.
– el fluorur de cesi és un donador habitual de fluor en la síntesi d’organofluorats.